题目内容
4.下列是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO | |
| C. | 向0.1 mol•L-1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 | |
| D. | 向浓度均为1.0×10-3 mol•L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
分析 A.弱电解质的电离平衡常数越小,说明该弱电解质的电离程度越小,则其相应离子的水解程度越大;
B.强酸能和弱酸盐反应生成弱酸;
C.缓冲溶液中pH=pKa+lg$\frac{弱酸盐}{弱酸}$;
D.混合溶液中生成氯化银需要的c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,生成Ag2CrO4需要的c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$,需要的银离子浓度小的物质先沉淀.
解答 解:A.次氯酸根离子的水解程度大于醋酸根离子,所以c(CH3COO-)>c(ClO-),故A错误;
B.酸性H2CO3>HClO>HCO3-,少量CO2通入次氯酸钠溶液中反应生成碳酸氢钠和次氯酸,离子方程式为:CO2+H2O+ClO-═HCO3-+HClO,故B错误;
C.缓冲溶液中pH=pKa+lg$\frac{弱酸盐}{弱酸}$=4.8+lg$\frac{9}{5}$=5.055≈5,故C正确;
D.混合溶液中生成氯化银需要的c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{1×1{0}^{-3}}$=1.8×10-7mol/L,生成Ag2CrO4需要的c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{1×1{0}^{-3}}}$mol/L=3×10-4.5mol/L,所以氯化银先沉淀,故D错误;
故选C.
点评 本题考查弱电解质的电离、难溶电解质的溶解平衡,明确弱酸的电离平衡常数越大其酸性越强,则弱酸根离子的水解程度越小,注意ClO-、CO32-、HCO3-的水解程度大小顺序是CO32->ClO->HCO3-,难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 碱性氢氧燃料电池的正极反应:H2-2e-+2OH-═2H2O | |
| B. | 用电子式表示NaCl的形成过程: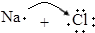 →Na+[ →Na+[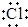 ]- ]- | |
| C. | 少量二氧化硫通入次氯酸钠碱性溶液中:SO2+C1O一+2OH-═SO42-+Cl-+H2O | |
| D. | 汽车尾气系统的催化转化器可降低NO等的排放:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2 |
| A. | 甲烷、二氧化碳和水都是由极性键构成的非极性分子 | |
| B. | 一氧化二氮和二氧化碳为等电子体,它们的摩尔质量都是44g | |
| C. | 在二氧化碳晶体中,与每个二氧化碳分子距离相等且最近的二氧化碳分子有6个 | |
| D. | 在冰中,每个水分子与相邻的四个水分子形成4个氢键 |
| A. | ①检查装置气密性 | B. | ②读取气体体积 | ||
| C. | ③验证苯中是否有碳碳双键 | D. | ④实验室制取并收集氨气 |
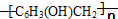 是制作电木的原料.下列围绕此物质的讨论正确的是( )
是制作电木的原料.下列围绕此物质的讨论正确的是( )| A. | 该有机物没有确定的熔点 | B. | 该有机物通过加聚反应得到 | ||
| C. | 该有机物通过苯酚和甲醇反应得到 | D. | 该有机物的单体是-C6H3OHCH2- |
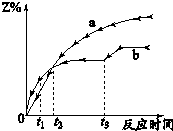 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )| A. | 曲线a是500℃时的图象 | |
| B. | 从0到t1时刻,反应物X(g)的$\frac{v(300℃)}{v(500℃)}$>1 | |
| C. | t2时刻生成物Z的量$\frac{{△v}_{1}(300℃)}{{△v}_{1}(500℃)}$ | |
| D. | t3时刻改变的条件可能是降温 |
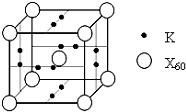 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题: 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验: 2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:
2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题: