题目内容
12.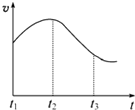 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少.
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快.
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是反应放热,溶液温度升高,反应速率加快,t2~t3速率变化的主要原因是随反应进行,盐酸的浓度减小较大,反应速度减慢.
(2)实验②放出氢气的量减少的原因是Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少.
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?正确(填“正确”或“不正确”).请选择下列相应的a或b作答.
a、若不正确,请说明原因:-
b、若正确则写出实验③中原电池的正极电极反应式2H++2e-=H2↑.
分析 (1)纯锌与稀盐酸反应,放出热量,速率加快,后期c(H+)起主导作用,随着反应进行c(H+)降低,反应速率减慢;
(2)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少;
(3)锌先与铜离子反应生成铜,然后铜与锌形成原电池,导致反应速率加快;正极氢离子得到电子生成氢气.
解答 解:(1)开始温度起主要作用,纯锌与稀盐酸反应,放出热量,温度升高,t1~t2速率加快;后期c(H+)起主导作用,随着反应进行c(H+)降低,t2~t3反应速率减慢,
故答案为:反应放热,溶液温度升高,反应速率加快;随反应进行,盐酸的浓度减小较大,反应速度减慢;
(2)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少,生成氢气量减少,
故答案为:Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少;
(3)实验③中锌与铜离子发生置换反应生成金属铜,生成的铜与锌形成了原电池,锌为负极,铜为正极,负极电极反应式为:Zn-2e-=Zn2+,H+在正极发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:正确;2H++2e-=H2↑.
点评 本题考查探究影响化学反应速率的因素,题目难度中等,侧重考查学生对知识的迁移运用,涉及外界条件对反应速率的影响、原电池原理,电极反应式书写是难点,注意在学习中多加练习.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺.化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护.在ABS工程塑料表面进行化学镀镍的流程如下:
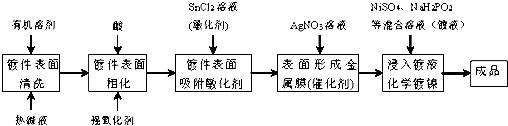
回答下列问题:
(1)化学镀与电镀比较,优点之一是不需通电.
(2)镀件表面用热碱液清洗的作用是除去镀件表面油污,镀件表面粗化的目的是增强亲水性及增大接触面积.
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4.
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3.
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如表所示:
由此推断,镀层厚度y与反应时间t的关系式为y=at1/2;欲使镀层厚度为6anm,需要的反应时间为36s.
(6)化学镀镍废液中含有Ni 2+等污染物,需转化为沉淀除去.已知25℃,Ksp[Ni(OH)2]=2.0×10-15.若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为1.2×10-2mg•L-1.

回答下列问题:
(1)化学镀与电镀比较,优点之一是不需通电.
(2)镀件表面用热碱液清洗的作用是除去镀件表面油污,镀件表面粗化的目的是增强亲水性及增大接触面积.
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4.
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3.
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如表所示:
| 反应时间t/s | 1 | 4 | 9 | 16 |
| 镀层厚度y/nm | a | 2a | 3a | 4a |
(6)化学镀镍废液中含有Ni 2+等污染物,需转化为沉淀除去.已知25℃,Ksp[Ni(OH)2]=2.0×10-15.若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为1.2×10-2mg•L-1.
7.如图为元素周期表的一部分,W、X,Y、Z均为短周期主族元素,下列分析一定正确的是( )
| W | X | |
| Y | Z |
| A. | Y的气态氢化物最稳定 | B. | Z的单核阴离子还原性最强 | ||
| C. | X单质常温下化学性质活泼 | D. | Y的原子序数比W大7 |
17.化学用语是学习化学的工具和基础.下列有关化学用语的使用正确的是( )
| A. | 食醋呈酸性的原因是:CH3COOH+H2O=CH3COO-+H3O+ | |
| B. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| C. | 用铁作阳极,电解饱和食盐水的离子方程式:Fe+2H2O $\frac{\underline{\;电解\;}}{\;}$ Fe(OH)2+H2↑ | |
| D. | 表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ•mol-1 |
4.下列是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO | |
| C. | 向0.1 mol•L-1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 | |
| D. | 向浓度均为1.0×10-3 mol•L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
1.下列相关反应的离子方程式书写正确的是( )
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O=CH3COO-+Al(OH)3↓ | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+=2Fe2++S↓ |
 .
.