题目内容
14. 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )| A. | 曲线a是500℃时的图象 | |
| B. | 从0到t1时刻,反应物X(g)的$\frac{v(300℃)}{v(500℃)}$>1 | |
| C. | t2时刻生成物Z的量$\frac{{△v}_{1}(300℃)}{{△v}_{1}(500℃)}$ | |
| D. | t3时刻改变的条件可能是降温 |
分析 A.温度越高,反应速率越大,到达平衡的时间越短;
B.温度越高反应速率越大;
C.设生成物Z的物质的量为n,则Z的含量=$\frac{n}{2+\frac{1}{3}n}$=$\frac{1}{\frac{2}{n}+\frac{1}{3}}$,根据Z的含量和Z的物质的量之间的关系式判断;
D.t3时刻,Z的含量增大,正反应是放热反应,降低温度平衡向正反应方向移动.
解答 解:A.根据“先拐先平数值大”知,b曲线到达平衡的时间小于a,则b反应速率大于a,温度越高,反应速率越快,所以a曲线的温度小于b曲线,则b是500℃时的图象,故A错误;
B.通过A知,b曲线温度大于a曲线,温度越高,反应速率越大,所以$\frac{v(300℃)}{v(500℃)}$<1,故B错误;
C.设生成物Z的物质的量为n,则Z的含量=$\frac{n}{2+\frac{1}{3}n}$=$\frac{1}{\frac{2}{n}+\frac{1}{3}}$,t2时刻生成物Z含量相等,则t2时刻生成物Z的物质的量n相等,其初始状态相等,所以$\frac{△n(300℃)}{△n(500℃)}$=1,故C错误;
D.该反应的正反应是放热反应,t3时刻,Z的含量增大,说明平衡向正反应方向移动,则可能改变的条件是降低温度,故D正确;
故选D.
点评 本题考查了物质百分含量与温度的关系,根据到达平衡的时间判断温度,再结合外界条件对化学反应速率及化学平衡的影响来分析解答,会根据曲线变化趋势及曲线的拐点来分析,题目难度中等.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
4.下列是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO | |
| C. | 向0.1 mol•L-1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 | |
| D. | 向浓度均为1.0×10-3 mol•L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
5.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,X与Z可形成常见的XZ或XZ2型分子,Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,W是原子半径最大的短周期元素.下列判断正确的是( )
| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
9.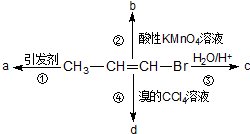 1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
 1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
19.有下列离子晶体立体结构示意图:
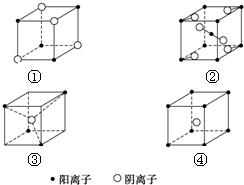
若以M代表阳离子,以N代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )

若以M代表阳离子,以N代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )
| A. | ①MN ②MN2 ③MN2 ④MN | B. | ①MN ②MN2 ③MN3 ④MN4 | ||
| C. | ①MN2 ②MN2 ③MN2 ④MN | D. | ①MN ②MN ③MN2 ④MN2 |
6.下列烷烃在光照下与氯气反应,只生成一种一氯代物的是( )
| A. | CH3CH2CH2CH3 | B. | 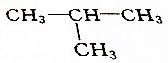 | ||
| C. | CH3CH2CH3 | D. | 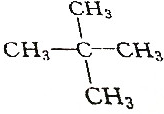 |
4.下列排列顺序不正确的是( )
| A. | 非金属性:F>Cl>S | B. | 熔点:SiO2>KCl>I2 | ||
| C. | 稳定性:HF>H2S>H2O | D. | 碱性:KOH>NaOH>Al(OH)3 |

 .
. ;
;