题目内容
3.碘及其化合物可广泛用于医药和工业生产等.(1)实验室用海带提取I2时操作步骤依次为:灼烧、溶解、过滤、氧化、萃取(或萃取分液)及蒸馏.
(2)灼烧海带时除需要三脚架、酒精灯、玻璃棒外,还需要的实验仪器是坩埚(或瓷坩埚)、泥三角.
(3)“过滤”后溶液中含一定量硫酸盐和碳酸盐.现要检验溶液中的I-,需选择的试剂组合及其先后顺序是ba.(选填编号)
a.AgNO3溶液 b.Ba(NO3)2溶液 c.BaCl2溶液 d.CaCl2溶液
(4)在海带灰滤液中加入适量氯水后一定存在I2,可能存在IO3-.
请补充完整检验含I2溶液中是否含有IO3-的实验方案(可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液):
①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明滤液中含有IO3-,若溶液不变蓝,说明滤液中不含有IO3-.
(5)分解水可用SO2/I2循环法.该法共涉及三步化学反应.SO2+I2+2H2O=2HI+H2SO4;2H2SO4$\stackrel{△}{→}$ 2SO2↑+O2↑+2H2O;2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2.与传统的分解水的方法相比,本法的优点是节约电能;缺点是使用能造成污染环境的SO2.
分析 (1)海带中碘以离子形式存在,烧、溶解、过滤后,需要加氧化剂转化为碘单质,再萃取碘;
(2)灼烧海带时在坩埚中进行;
(3)“过滤”后溶液中含一定量硫酸盐和碳酸盐.现要检验溶液中的I-,显加硝酸钡排除硫酸盐和碳酸盐的干扰,再利用硝酸银检验碘离子;
(4)检验含I2溶液中是否含有IO3-,萃取后,利用水层是否具有氧化性来说明;
(5)分解水可用SO2/I2循环法,先发生氧化还原反应生成硫酸、HI,再发生硫酸的分解、HI的分解反应,从而避免电解水的能源消耗,但有二氧化硫的排放.
解答 解:(1)海带中碘以离子形式存在,烧、溶解、过滤后,需要加氧化剂转化为碘单质,再萃取碘,则步骤为灼烧、溶解、过滤、氧化、萃取(或萃取分液) 及蒸馏,
故答案为:氧化;萃取(或萃取分液);
(2)灼烧海带时在坩埚中进行,则需要的仪器为三脚架、酒精灯、玻璃棒、坩埚(或瓷坩埚)、泥三角,故答案为:坩埚(或瓷坩埚)、泥三角;
(3)“过滤”后溶液中含一定量硫酸盐和碳酸盐.现要检验溶液中的I-,显加硝酸钡排除硫酸盐和碳酸盐的干扰,再利用硝酸银检验碘离子,则需选择的试剂组合及其先后顺序是ba,故答案为:ba;
(4)检验含I2溶液中是否含有IO3-,步骤为①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;②从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明滤液中含有IO3-,若溶液不变蓝,说明滤液中不含有IO3-,
故答案为:从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明滤液中含有IO3-,若溶液不变蓝,说明滤液中不含有IO3-;
(5)分解水可用SO2/I2循环法,先发生氧化还原反应生成硫酸、HI,再发生硫酸的分解、HI的分解反应,涉及的反应为SO2+I2+2H2O=2HI+H2SO4、2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+O2↑+2H2O、2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2,与传统的分解水的方法相比,本法的优点是节约电能;缺点是使用能造成污染环境的SO2,
故答案为:SO2+I2+2H2O=2HI+H2SO4;2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2;节约电能;使用能造成污染环境的SO2.
点评 本题考查海水资源利用及分离提纯实验方案的设计,为高频考点,把握氧化还原反应原理、离子检验及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.

(1)提出合理假设:
假设1:FeSO4有剩余;
假设2:NaClO有剩余;
假设3:NaClO和FeSO4都无剩余
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液.此澄清溶液中肯定含有的金属阳离子是Na+,Fe3+
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | ||
| 步骤3 | ||
| A. | 3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 2c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) | |
| C. | c(K+)>c(Na+)>c(HCO3-)+c(CO32-)>c(OH-)>c(H+) | |
| D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1 mol•L-1 |
| A. | 嘴嚼米饭时有甜味(化学变化) | |
| B. | 玻璃窗破裂(化学变化) | |
| C. | 二氧化碳使澄清的石灰水变浑浊(物理变化) | |
| D. | 纯净物加热后变为混合物(物理变化) |
| A. | 硝酸钾和氯化钠的混合物 | B. | 溴水 | ||
| C. | 汽油和柴油 | D. | 四氯化碳和水 |
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=1.0 mol•L-1•min-1 | ||
| C. | v(H2)=1.67 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
| A. | 能够提高化学反应速率 | B. | 能够提高产品的产量 | ||
| C. | 能够提高经济效益 | D. | 能够节约原料和能源 |
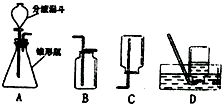 过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:
过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题: .
.