题目内容
12.反应N2+3H2?2NH3,开始时N2的浓度为3mol•L-1,H2的浓度为5mol•L-1,3min后测得NH3浓度为0.6mol•L-1,则此时间内,下列反应速率表示正确的是( )| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=1.0 mol•L-1•min-1 | ||
| C. | v(H2)=1.67 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
分析 该时间内v(NH3)=$\frac{0.6-0}{3}$mol•L-1•min-1=0.2 mol•L-1•min-1,再根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比计算氢气、氮气反应速率,据此分析解答.
解答 解:该时间内v(NH3)=$\frac{0.6-0}{3}$ mol•L-1•min-1=0.2 mol•L-1•min-1,再根据同一可逆反应同一时间段内各物质的反应速率之比得v(N2)=$\frac{1}{2}$×v(NH3)=$\frac{1}{2}$×$\frac{0.6-0}{3}$ mol•L-1•min-1=0.1 mol•L-1•min-1,
v(H2)=$\frac{3}{2}$×0.2 mol•L-1•min-1=$\frac{3}{2}$×$\frac{0.6-0}{3}$ mol•L-1•min-1=0.3mol•L-1•min-1,
A.v(NH3)=0.2 mol•L-1•min-1=0.0033mol•L-1•s-1,故A错误;
B.v(N2)=$\frac{1}{2}$×v(NH3)=$\frac{1}{2}$×$\frac{0.6-0}{3}$ mol•L-1•min-1=0.1 mol•L-1•min-1,故B错误;
C.v(H2)=$\frac{3}{2}$×0.2 mol•L-1•min-1=$\frac{3}{2}$×$\frac{0.6-0}{3}$ mol•L-1•min-1=0.3mol•L-1•min-1,故C错误;
D.v(H2)=$\frac{3}{2}$×0.2 mol•L-1•min-1=$\frac{3}{2}$×$\frac{0.6-0}{3}$ mol•L-1•min-1=0.3mol•L-1•min-1,故D正确;
故选D.
点评 本题考查化学反应速率计算,侧重考查分析计算能力,明确各物质反应速率与计量数关系即可解答,注意单位换算,为易错点.

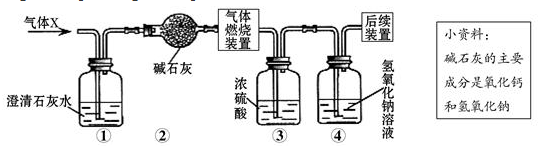
| A. | 一定没有二氧化碳 | B. | 可能含有甲烷和氢气 | ||
| C. | 可能只有甲烷 | D. | 可能含有氢气和一氧化碳 |
| A. | ③⑤⑧ | B. | ④⑤⑦ | C. | ④⑤⑧ | D. | ③⑥⑦ |
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增效应大于热效应 |
| A. | 甲烷和乙烷 | B. | 正丁烷和异丁烷 | C. | 金刚石和石墨 | D. | 35Cl 和37Cl |
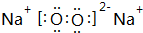 ,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.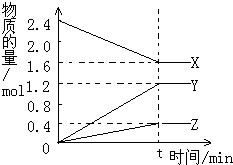 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示: