题目内容
14.现有0.2 mol•L-1的KHCO3溶液和0.1 mol•L-1的NaOH溶液,将两溶液等体积混合,下列说法正确的是( )| A. | 3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 2c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) | |
| C. | c(K+)>c(Na+)>c(HCO3-)+c(CO32-)>c(OH-)>c(H+) | |
| D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1 mol•L-1 |
分析 0.2 mol•L-1的KHCO3溶液和0.1 mol•L-1的NaOH溶液,将两溶液等体积混合,得到浓度都0.05 mol•L-1的碳酸根离子、碳酸氢根离子和钠离子,而钾离子为0.1 mol•L-1,其中碳酸根离子的水解程度大于碳酸氢根离子的水解程度,由此分析解答.
解答 解:A、根据电荷守恒c(K+)+c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),而c(K+)=2c(Na+),所以3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A正确;
B、根据物料守恒,c(K+)=c(HCO3-)+c(CO32-)+c(H2CO3),又因为:c(K+)=2c(Na+),所以2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B错误;
C、碳酸根离子的水解程度大于碳酸氢根离子的水解程度,水解溶液呈碱,c(HCO3-)+c(CO32-)=2c(Na+),所以c(K+)=2c(Na+)c(HCO3-)+c(CO32-)>c(Na+)>c(OH-)>c(H+),故C错误;
D、根据电荷守恒c(K+)+c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①,根据物料守恒,c(K+)=c(HCO3-)+c(CO32-)+c(H2CO3)②,将②代入①得c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.05 mol•L-1,故D错误;
故选A.
点评 本题考查混合溶液中离子浓度大小的比较,首先应先让其反应,观察反应后的溶质,然后考虑电离和水解,在其过程中学生要注意守恒的巧妙应用,有一定的难度.

练习册系列答案
相关题目
8.阿托酸乙酯可用于辅助胃肠道痉挛及溃疡.结构如图所示,下列说法正确的是( )


| A. | 能使高锰酸钾褪色,不能使溴水褪色 | |
| B. | 1mol阿托酸乙酯最多能与5mol H2加成 | |
| C. | 能发生加成、加聚、氧化、水解等反应 | |
| D. | 分子式为C11H13O2 |
5.下表是元素周期表的一部分,回答下列有关问题:
(1)在上表所列出的元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(2)③和⑤最高价氧化物所对应的水化物之间可以反应,写出反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)①、⑥、⑦、⑧最高价氧化物所对应的水化物中性质明显不同的是H2SiO3.(填化学式)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)③和⑤最高价氧化物所对应的水化物之间可以反应,写出反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)①、⑥、⑦、⑧最高价氧化物所对应的水化物中性质明显不同的是H2SiO3.(填化学式)
2.某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种.为确认其组成,某同学取一定量该气体按下图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,④中增重2.2g.下列关于气体X成分的分析中,错误的是( )
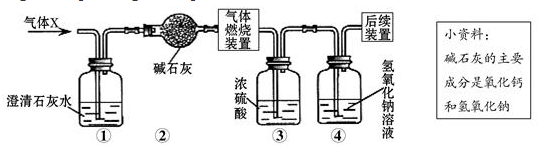

| A. | 一定没有二氧化碳 | B. | 可能含有甲烷和氢气 | ||
| C. | 可能只有甲烷 | D. | 可能含有氢气和一氧化碳 |
6.在饱和碳酸钠溶液中通入CO2,将所得溶液小心蒸干,得到固体A,为分析A的成分,设计如下实验方案.
(1)甲实验:用pH计检验A是否为纯净的碳酸氢钠.25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是纯净的碳酸氢钠.
(2)乙实验:将A配成溶液与BaCl2溶液等体积混合,通过观察实验现象判断A是否为纯净的碳酸氢钠,下表是几组实验的现象:产生浑浊的原因可能是①A中含有碳酸钠;②碳酸氢钡溶液密度增大析出沉淀.
(3)丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是黄色变为橙色且半分钟不褪色.
(4)丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于坩埚(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行2次,当剩余固体质量为6.310克(保留3位小数)时,证明A为纯净的碳酸氢钠固体.
(1)甲实验:用pH计检验A是否为纯净的碳酸氢钠.25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是纯净的碳酸氢钠.
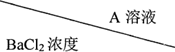 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(3)丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是黄色变为橙色且半分钟不褪色.
(4)丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于坩埚(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行2次,当剩余固体质量为6.310克(保留3位小数)时,证明A为纯净的碳酸氢钠固体.
4.25℃、101kPa下,反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.7kJ/mol能自发进行的原因是( )
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增效应大于热效应 |