题目内容
13.分某学习小组在研究水处理问题时,将一定量NaClO溶液与FeSO4溶液相混合,得到含有大量悬浮物的混合液.请完成对反应物剩余情况的探究.(1)提出合理假设:
假设1:FeSO4有剩余;
假设2:NaClO有剩余;
假设3:NaClO和FeSO4都无剩余
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液.此澄清溶液中肯定含有的金属阳离子是Na+,Fe3+
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | ||
| 步骤3 | ||
分析 (1)依据假设1和假设2,得到假设3应为二者全部反应,溶液中无NaClO和FeSO4剩余;
(2)取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液,次氯酸根离子具有氧化性,氧化亚铁离子为铁离子,溶液中阳离子一定存在钠离子和铁离子;
(3)根据离子的检验方法,Fe2+、ClO- 的检验都有几种方法,根据给定的试剂和存在的离子情况,要排除干扰选择实验检验方案,该题就是存在Fe3+离子情况下,检验Fe2+、ClO-,检验Fe2+常用的方法,①NaOH溶液,②KSCN和氯水 ③酸性KMnO4溶液;HClO有三个主要性质:弱酸性、不稳定性,强氧化性,检验ClO-检验常用的方法有:①检验其酸性条件下的漂白性②强氧化性;由于Fe3+有氧化性的干扰,不能选择淀粉-KI溶液(2Fe3++2I-=2Fe2++I2,ClO-+2H++2I-=Cl-+H2O+I2 ),应该选择紫色石蕊溶液检验其漂白性;
解答 解:(1)对反应物剩余情况的探究,就是要对反应后的溶液中存在的主要离子(Fe2+、ClO- )检验,从而完成对剩余情况的探究,假设1:FeSO4有剩余;假设2:NaClO有剩余;假设3溶液中无NaClO和FeSO4剩余;
故答案为:NaClO和FeSO4都无剩余;
(2)取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液,次氯酸根离子具有氧化性,氧化亚铁离子为铁离子,溶液中阳离子一定存在钠离子和铁离子,酸性溶液中发生反应:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,溶液中一定存在的金属阳离子为Fe3+,Na+;
故答案为:Fe3+,Na+;
(3)验证假设实验探究是存在Fe3+离子情况下,检验Fe2+、ClO-;
检验Fe2+常用的方法,①NaOH溶液,②KSCN和氯水 ③酸性KMnO4溶液,试剂中只能用③酸性KMnO4溶液检验亚铁离子的存在;
HClO有三个主要性质:弱酸性、不稳定性,强氧化性,检验ClO-检验常用的方法有:①检验其酸性条件下的漂白性②强氧化性;由于Fe3+有氧化性的干扰,不能选择淀粉-KI溶液.(2Fe3++2I-=2Fe2++I2,ClO-+2H++2I-=Cl-+H2O+I2 ),选择紫色石蕊溶液检验其漂白性;
实验设计步骤和现象为:
步骤2、向A试管中滴加1-2滴0.01mol/L的高锰酸钾溶液,
现象和结论:(1)若溶液紫红色褪去,则假设1正确,
(2)若溶液呈紫红色,则假设2或假设3正确
步骤3、向B试管中滴加1-2滴石蕊试液,
现象和结论:(1)若溶液先变红色后褪色,则假设2正确,
(2)若石蕊试液变红色后不褪色,结合步骤2中的(2)则假设3正确;
故答案为:
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | 向A试管中滴加1-2滴0.01mol/L的高锰酸钾溶液 | (1)若溶液紫红色褪去,则假设1正确, (2)若溶液呈紫红色,则假设2或假设3正确 |
| 步骤3 | 向B试管中滴加1-2滴石蕊试液 | (1)若溶液先变红色后褪色,则假设2正确, (2)若石蕊试液变红色后不褪色,结合步骤2中的(2)则假设3正确; |
点评 本题考查了物质组成的实验探究,化学实验探究题是对学生综合能力的考查,要解答好化学实验探究题,学生必需要有扎实的基础和一定实验技能,同时要熟悉解题的思路,才能得心应手,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | 曲线a是使用了催化剂的能量变化曲线 | |
| B. | 反应物的总键能高于生成物的总键能 | |
| C. | 反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)-115.6 kJ | |
| D. | 若反应生成2mol液态水,放出的热量高于115.6kJ |
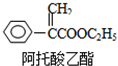
| A. | 能使高锰酸钾褪色,不能使溴水褪色 | |
| B. | 1mol阿托酸乙酯最多能与5mol H2加成 | |
| C. | 能发生加成、加聚、氧化、水解等反应 | |
| D. | 分子式为C11H13O2 |
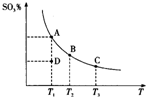 二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )| A. | 在D点时,反应逆向进行 | |
| B. | 反应2SO2(g)+O2(g)?2SO3(g)的△H>0 | |
| C. | 若B、C点的平衡常数分别为KB、KC,则KB>KC | |
| D. | 恒温恒压下向平衡体系中通入氦气,平衡向左移动 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)③和⑤最高价氧化物所对应的水化物之间可以反应,写出反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)①、⑥、⑦、⑧最高价氧化物所对应的水化物中性质明显不同的是H2SiO3.(填化学式)
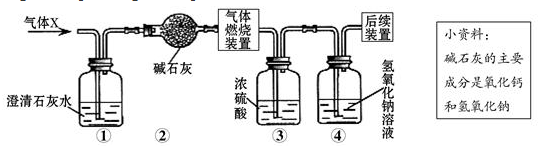
| A. | 一定没有二氧化碳 | B. | 可能含有甲烷和氢气 | ||
| C. | 可能只有甲烷 | D. | 可能含有氢气和一氧化碳 |
 按如图所示装置进行铁与水的反应实验,请回答下列问题:
按如图所示装置进行铁与水的反应实验,请回答下列问题: