题目内容
18.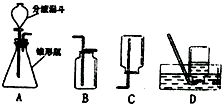 过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:
过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:(1)分液漏斗中应放入的物质是过氧化氢溶液,锥形瓶中应放入的物质是二氧化锰
(2)写出用该方法制取氧气的化学反应文字表达式:过氧化氢→水+氧气;要收集一瓶纯净的氧气,应选择装置D(填字母);
(3)某同学观察到锥形瓶内有大量气泡时,开始用B装置收集氧气,过一段时间后用带火星的木条伸入瓶口、瓶中和瓶底,都末见木条复燃.其原因可能是装置的气密性不好.
分析 (1)依据过氧化氢、二氧化锰状态分析解答;
(2)过氧化氢在二氧化锰催化剂条件下反应生成水和氧气;氧气难溶于水,要收集一瓶纯净的氧气,可以用排水法收集;
(3)装置漏气会造成收集不到气体.
解答 解:(1)过氧化氢为液体,应盛放着分液漏斗中,二氧化锰为固体,应盛放着锥形瓶中;
故答案为:过氧化氢溶液;二氧化锰;
(2)氧化氢在二氧化锰催化剂条件下反应生成水和氧气,用该方法制取氧气的化学反应文字表达式:过氧化氢→水+氧气;氧气难溶于水,要收集一瓶纯净的氧气,可以用排水法收集;
故答案为:过氧化氢→水+氧气;D;
(3)某同学观察到锥形瓶内有大量气泡时,开始用B装置收集氧气,过一段时间后用带火星的木条伸入瓶口、瓶中和瓶底,都末见木条复燃.其原因可能是装置的气密性不好,漏气,
故答案为:装置的气密性不好.
点评 本题考查了氧气的实验室制备方法,明确制备原理及常见仪器的使用方法和注意事项是解题关键,题目难度不大.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
6.在饱和碳酸钠溶液中通入CO2,将所得溶液小心蒸干,得到固体A,为分析A的成分,设计如下实验方案.
(1)甲实验:用pH计检验A是否为纯净的碳酸氢钠.25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是纯净的碳酸氢钠.
(2)乙实验:将A配成溶液与BaCl2溶液等体积混合,通过观察实验现象判断A是否为纯净的碳酸氢钠,下表是几组实验的现象:产生浑浊的原因可能是①A中含有碳酸钠;②碳酸氢钡溶液密度增大析出沉淀.
(3)丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是黄色变为橙色且半分钟不褪色.
(4)丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于坩埚(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行2次,当剩余固体质量为6.310克(保留3位小数)时,证明A为纯净的碳酸氢钠固体.
(1)甲实验:用pH计检验A是否为纯净的碳酸氢钠.25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是纯净的碳酸氢钠.
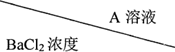 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(3)丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是黄色变为橙色且半分钟不褪色.
(4)丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于坩埚(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行2次,当剩余固体质量为6.310克(保留3位小数)时,证明A为纯净的碳酸氢钠固体.
10.下列实验设计方案中,可行的是( )
| A. | 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO42- | |
| D. | 先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
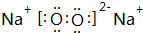 ,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.