题目内容
8.碳酸钠中含有少量硫酸钠,下列是测定样品纯度的方案:方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
| A. | 方案一优于方案二,因为CaCl2比BaCl2更便宜 | |
| B. | 方案一优于方案二,因为其沉淀物溶解度更小沉淀更安全 | |
| C. | 用乙醇洗涤沉淀比用水洗涤,测量结果更准确 | |
| D. | 以上两种方案都必须采集样品的质量、沉淀剂和沉淀物的质量 |
分析 碳酸钠中含有少量硫酸钠,可加入氯化钙或氯化钡,根据样品的质量和生成沉淀的质量列方程式组计算样品的纯度,由于硫酸钙微溶于水,则生成的硫酸钠不能全部转化为沉淀,可导致较大误差,应选择氯化钡较好,如洗涤沉淀,应选择乙醇,可减小溶质的损失,以此解答该题.
解答 解:由于硫酸钙微溶于水,则生成的硫酸钠不能全部转化为沉淀,可导致较大误差,应选择氯化钡,
假设碳酸钠为xmol,硫酸钠为ymol,样品质量为w1,生成沉淀质量为w2,
则$\left\{\begin{array}{l}{106x+142y={w}_{1}}\\{197x+233y={w}_{2}}\end{array}\right.$,可计算样品的纯度.
洗涤沉淀,应选择乙醇,可减小溶质的损失,只有C符合,
故选C.
点评 本题考查实验方案的评价,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握实验的原理和物质的性质,为解答该题的关键,难度不大.

练习册系列答案
相关题目
18.常温下,对物质的量浓度均为0.1mol•L-1的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,下列说法错误的是( )
| A. | 溶液的pH大小顺序是③>①>② | |
| B. | 分别向其中逐滴滴入相同浓度的盐酸至中性,消耗盐酸最少的是② | |
| C. | 分别稀释相同倍数后,pH变化最大的是② | |
| D. | 分别加入25mL 0.1 mol•L-1盐酸后,pH最大的是① |
19.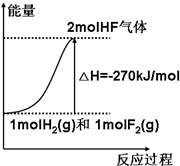 已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
 已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )| A. | 该反应的逆反应是放热反应 | |
| B. | 该反应过程的能量变化可用右图来表示 | |
| C. | 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量小于270 kJ | |
| D. | 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量 |
16.某溶液仅含Fe2+、Na+、A13+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入少量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
| A. | 若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 该溶液中所含的离子是Fe2+、Na+、SO42-、NO3- | |
| D. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
3.常温下,在制定溶液中下列各组离子能大量共存的是( )
| A. | 含HS-溶液中:K+、Cu2+ NO3-、SO42- | |
| B. | 某无色透明的溶液:Mg2+、ClO-、SiO32- Na+ | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+ K+、NO3- HCO3- | |
| D. | pH=0:Na+ Ca2+ Fe3+ NO3- Cl- |
8.下列各组中互为同素异形体关系的是( )
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题: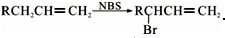 .醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路: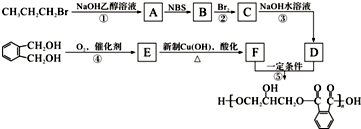
 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.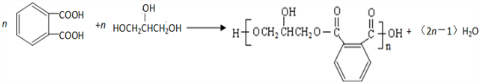 .
.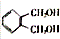 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.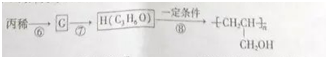
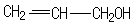 .
.