题目内容
11.下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是
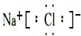 .
.(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
分析 第二、第三周期元素中,①③均有+1价,处于ⅠA族,原子半径①>③,故①为Na、③为Li;⑤⑦均有+5、-3价,处于ⅤA,原子半径⑤>⑦,则⑤为P、⑤为N;⑥有+7、-1价,故⑥为Cl;⑧有-2价,处于ⅥA族,没有正化合价,原子半径小于Cl,故⑧为O;②有+2价,处于ⅡA族,原子半径大于P,故②为Mg;④有+3价,处于ⅢA族,原子半径大于P,故④为Al,结合元素周期律与元素化合物性质解答.
解答 解:第二、第三周期元素中,①③均有+1价,处于ⅠA族,原子半径①>③,故①为Na、③为Li;⑤⑦均有+5、-3价,处于ⅤA,原子半径⑤>⑦,则⑤为P、⑤为N;⑥有+7、-1价,故⑥为Cl;⑧有-2价,处于ⅥA族,没有正化合价,原子半径小于Cl,故⑧为O;②有+2价,处于ⅡA族,原子半径大于P,故②为Mg;④有+3价,处于ⅢA族,原子半径大于P,故④为Al.
(1)⑧是O元素,O原子核外有2个电子层,最外层有6个电子,所以在元素周期表中的位置是:第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)非金属的非金属性越强其最高价含氧酸的酸性越强,上述元素中非金属元素是Cl元素,故8个元素的最高价氧化物的水化物中,酸性最强的是HClO4,
故答案为:HClO4;
(3)①元素和⑥元素形成化合物是氯化钠,氯化钠的电子式是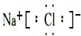 ,
,
故答案为: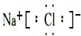 ;
;
(4)④最高价氧化物对应水化物是氢氧化铝,⑥氢化物为HCl,氢氧化铝和盐酸反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O;
(5)A.③是Li元素、④是Al元素,分别处于第二、三周期,③、④处于不同周期,故正确;
B.②Mg元素,⑧是O元素,②的阳离子与⑧的阴离子的核外电子数相等,都是10个电子,故正确;
C.⑥是Cl元素,F在其同主族元素中非金属性最强,故错误;
D.⑤是P元素、⑦是N元素,二者位于同一主族,两者核电荷数之差是8,故正确;
E.①是Na元素、⑧是O元素,①与⑧形成的化合物没有两性,故错误;
故选:ABD.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解本题关键,知道常见元素化合价,难度不大.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | 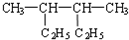 2,3-二乙基丁烷 | B. | 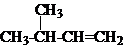 2-甲基-3-丁烯 | C. | 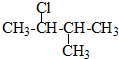 3-甲基-2-氯丁烷 | D. | 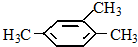 1,3,4-三甲苯 |
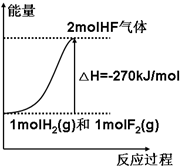 已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )| A. | 该反应的逆反应是放热反应 | |
| B. | 该反应过程的能量变化可用右图来表示 | |
| C. | 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量小于270 kJ | |
| D. | 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量 |
| 实验. 序号 | 碳酸钙 | C(HCl)/ mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
(2)实验5、6目的是探究温度对反应速率的影响,结果说明当其他条件相同时,温度越高,反应速率越快.
(3)根据实验1、3、5或实验2、4可以得出条件对反应速率的影响规律是其他条件一定,反应物浓度越大,反应速率越快.
(4)从本实验数据中分析,影响化学反应速率的因素还有反应物的接触面积,能表明这一规律的两个实验序号是1和2.
| A. | 若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 该溶液中所含的离子是Fe2+、Na+、SO42-、NO3- | |
| D. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
| A. | 含HS-溶液中:K+、Cu2+ NO3-、SO42- | |
| B. | 某无色透明的溶液:Mg2+、ClO-、SiO32- Na+ | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+ K+、NO3- HCO3- | |
| D. | pH=0:Na+ Ca2+ Fe3+ NO3- Cl- |
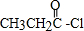 ;
;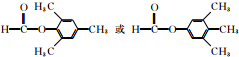 (任写一种).
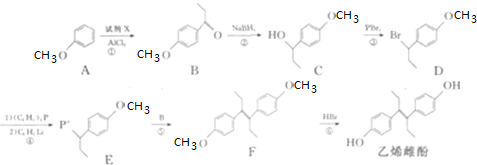
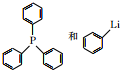
(任写一种).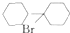 可由
可由 经五步反应合成:
经五步反应合成: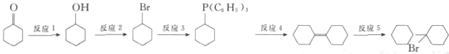
 (写结构简式);
(写结构简式);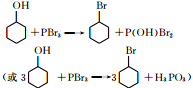 ;
;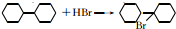 .
.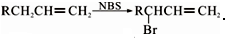 .醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路: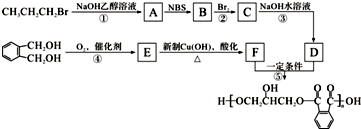
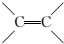 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.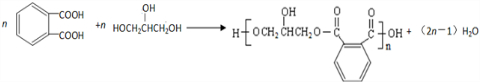 .
.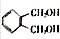 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.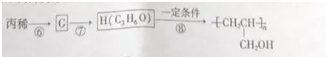
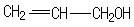 .
.