题目内容
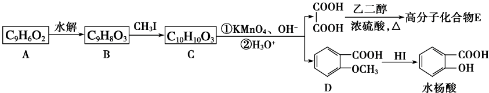
3.已知:①CH3CH═CHCH2CH3$→_{②H_{3}O+}^{①KMnO_{4}、OH-}$CH3COOH+CH3CH2COOH②R-CH═CH2$→_{过氧化物}^{HBr}$R-CH2-CH2-Br,香豆素的主要成分是芳香内酯A,A经下列步骤转化为水杨酸.
请回答下列问题:
(1)写出A的结构简式
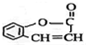 .
.(2)B分子中有2个含氧官能团,分别为羧基和羧基(填官能团名称),B→C的反应类型为取代反应.
(3)在上述转化过程中,反应步骤B→C的目的是保护酚羟基,使之不被氧化.
(4)下列有关A、B、C的叙述中不正确的是c(填序号).
a.C的核磁共振氢谱中共有8组峰
b.A、B、C均可发生加聚反应
c.1mol A最多能与5mol氢气发生加成反应
d.B能与浓溴水发生取代反应
(5)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应,请写出其中一种的结构简式:
 .
.(6)写出合成高分子化合物E的化学反应方程式:
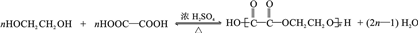 .
.(7)写出以
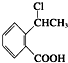 为原料制
为原料制 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如下:
分析 C被高锰酸钾氧化生成乙二酸和D,结合题给信息及C的分子式知,C的结构简式为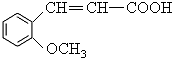 ,B和CH3I发生取代反应生成C,则B的结构简式为:
,B和CH3I发生取代反应生成C,则B的结构简式为: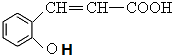 ,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为:
,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为: ,D在HI条件下发生取代反应生成水杨酸.(5)中
,D在HI条件下发生取代反应生成水杨酸.(5)中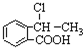 在氢氧化钠的醇溶液、加热条件下发生消去反应生成
在氢氧化钠的醇溶液、加热条件下发生消去反应生成 ,
, 与HBr发生加成反应生成
与HBr发生加成反应生成 ,
, 在氢氧化钠的水溶液、加热条件下发生取代反应生成
在氢氧化钠的水溶液、加热条件下发生取代反应生成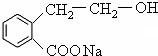 ,
,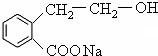 在浓硫酸加热条件下发生酯化反应生成
在浓硫酸加热条件下发生酯化反应生成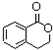 .
.
解答 解:(1)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)B的结构简式为: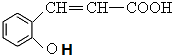 ,含氧官能团有羧基、酚羟基;B和CH3I发生取代反应生成C,故答案为:羧基、酚羟基;取代反应;
,含氧官能团有羧基、酚羟基;B和CH3I发生取代反应生成C,故答案为:羧基、酚羟基;取代反应;
(3)由于C→D转化过程发生氧化反应,可以氧化酚羟基,故反应步骤B→C的目的是:B生成C的目的是保护酚羟基,使之不被氧化,
故答案为:保护酚羟基,使之不被氧化;
(4)据ABC的结构简式可知,
a、C中有8种不同环境的氢原子,故a正确;
b、据ABC的结构简式可知,都有碳碳双键,能够发生加聚反应,故b正确;
c、A的结构简式为: ,1molA能够与4mol氢气加成,故c错误;
,1molA能够与4mol氢气加成,故c错误;
d、B中有酚羟基,能够与溴发生取代反应,故d正确;
故答案为:c;
(5)能够水解,说明含有酯基,水解生成的产物之一能发生银镜反应,说明是甲酸酯,其苯的对二取代物有: ,
,
故答案为: ;
;
(6)乙二酸和乙二醇通过酯化反应合成高分子化合物的化学方程式为: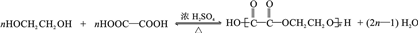 ,
,
故答案为: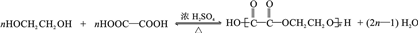 ;
;
(7)以 为原料制
为原料制 时,首先在NaOH的乙醇溶液中消去,再与HBr加成,再水解生成醇,酯化生成酯,合成路线流程图为:
时,首先在NaOH的乙醇溶液中消去,再与HBr加成,再水解生成醇,酯化生成酯,合成路线流程图为: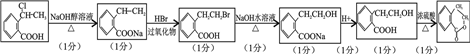 ,
,
故答案为: .
.
点评 本题考查有机物推断和合成,难点是推断D的同分异构体,注意水解生成的产物之一能发生银镜反应,说明是甲酸酯,难度较大

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
3.常温下,在制定溶液中下列各组离子能大量共存的是( )
| A. | 含HS-溶液中:K+、Cu2+ NO3-、SO42- | |
| B. | 某无色透明的溶液:Mg2+、ClO-、SiO32- Na+ | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+ K+、NO3- HCO3- | |
| D. | pH=0:Na+ Ca2+ Fe3+ NO3- Cl- |
8.下列各组中互为同素异形体关系的是( )
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
15.I.CH4和CO2可以制造价值更高的化学产品.已知:
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H1=a kJ/mol
CO(g)+H2O(g)?CO2(g)+H2(g)△H2=b kJ/mol
2CO(g)+O2(g)?2CO2(g)△H3=c kJ/mol
(1)求反应CH4(g)+CO2(g)?CO(g)+2H2(g)△H=a+2b-2c kJ/mol(用含a、b、c的代数式表示).
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为3CO+3H2═CH3OCH3+CO2.
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:
CO2(g)+CH4(g)?CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
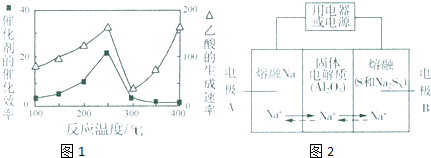
①250~300℃时,乙酸的生成速率降低的原因是催化剂的催化效率降低,化学反应速率降低.
②300~400℃时,乙酸的生成速率升高的原因是温度升高,化学反应速率加快.
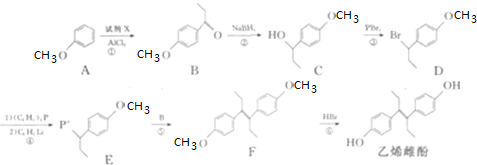
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
(4)根据上表数据,判断该电池工作的适宜温度应为C(填字母序号).
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.05mol,两极的反应物的质量差为2.3 g.(假设电解前两极的反应物的质量相等)
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H1=a kJ/mol
CO(g)+H2O(g)?CO2(g)+H2(g)△H2=b kJ/mol
2CO(g)+O2(g)?2CO2(g)△H3=c kJ/mol
(1)求反应CH4(g)+CO2(g)?CO(g)+2H2(g)△H=a+2b-2c kJ/mol(用含a、b、c的代数式表示).
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为3CO+3H2═CH3OCH3+CO2.
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:
CO2(g)+CH4(g)?CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:

①250~300℃时,乙酸的生成速率降低的原因是催化剂的催化效率降低,化学反应速率降低.
②300~400℃时,乙酸的生成速率升高的原因是温度升高,化学反应速率加快.
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.05mol,两极的反应物的质量差为2.3 g.(假设电解前两极的反应物的质量相等)
13.下列过程中,不需要破坏化学键的是( )
| A. | 氯化钠溶于水 | B. | 氯化氢溶于水 | C. | 干冰汽化 | D. | 加热分解氯化铵 |
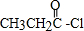 ;
;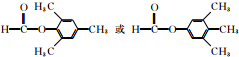 (任写一种).
(任写一种).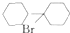 可由
可由 经五步反应合成:
经五步反应合成: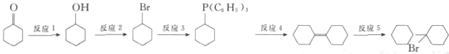
 (写结构简式);
(写结构简式); ;
;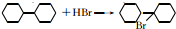 .
.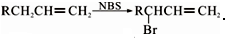 .醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路: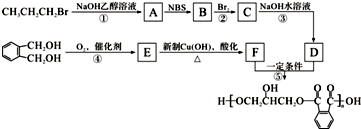
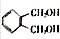
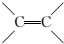 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.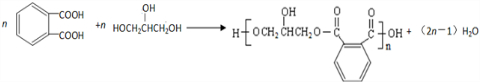 .
. 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.
 .
.