题目内容
20.下列离子方程式正确的是( )| A. | KI溶液中滴加稀硫酸:4H++4I-+O2=2I2+2H2O | |
| B. | 过量SO2通入氨水中:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+=Al(OH)3↓ | |
| D. | 氨水滴入AgNO3溶液中至沉淀完全:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
分析 A.碘离子在酸性条件下易被氧化成碘单质;
B.二氧化硫过量,反应生成亚硫酸氢铵;
C.稀盐酸过量,氢氧化铝溶解,反应生成铝离子;
D.沉淀完全时生成氢氧化银沉淀,氨水过量时生成银氨络离子.
解答 解:A.KI溶液中滴加稀硫酸,碘离子被氧气氧化,反应的离子方程式为:4H++4I-+O2=2I2+2H2O,故A正确;
B.二氧化硫过量,二者反应生成亚硫酸氢铵,正确的离子方程式为:NH3•H2O+SO2=NH4++HSO3-,故B错误;
C.NaAlO2溶液中滴加过量盐酸,反应生成氯化铝和氯化钠,正确的离子方程式为:AlO2-+4H+=Al3++2H2O,故C错误;
D.氨水滴入AgNO3溶液中至沉淀完全,反应生成氢氧化银,正确的离子方程式为:Ag++NH3•H2O=AgOH↓+NH4+,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
10. 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )| A. | 苯甲酸叶醇酯能发生氧化反应 | |
| B. | 苯甲本叶醇酯能使溴的四氯化碳溶液褪色 | |
| C. | 1mol苯甲酸叶醇酯最多能与4molH2发生加成反应 | |
| D. | 1mol苯甲酸叶醇酯与NaOH溶液反应时,能消耗2molNaOH |
11.25℃时进行四组实验,其中“实验内容”与对应“现象或结论”关系错误的是( )
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| C | 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉) | 阴极逸出气体且附近溶液渐呈红色 |
| D | 以Pb为负极,硫酸溶液为电解质的铅蓄电池,在放电过程中 | 负极质量增加,SO42-向负极迁移,溶液pH增大 |
| A. | A | B. | B | C. | C | D. | D |
12.下列物质中,属于电解质的是( )
| A. | NH3 | B. | 铜 | C. | 酒精 | D. | 硫酸 |
9.下列反应的方程式正确的是( )
| A. | AlCl3溶液中滴加浓氨水至过量:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | MnO2与浓盐酸反应制取Cl2:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | 小苏打溶液中加入足量稀盐酸:HCO3-+H+=CO2↑+H2O | |
| D. | 电解饱和食盐水的阴极反应:2Cl--2e-=Cl2↑ |
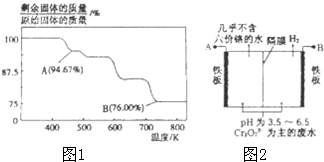 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.


