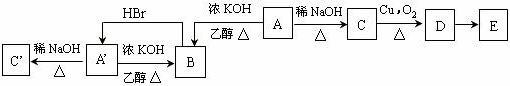
题目内容
8.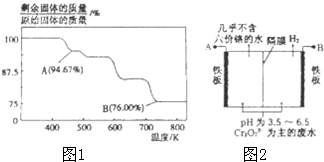 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.请回答下列问题:
(1)B点时剩余固体的化学式是Cr2O3.
(2)加热至A点时反应的化学方程式为6CrO3$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3O8+O2↑.
(3)CrO3具有两性,写出CrO3溶解于KOH溶液的反应化学方程式CrO3+2KOH=K2CrO4+H2O.
(4)三氧化铬还用于交警的酒精测试仪,以检查司机是否酒后驾车,若反应后红色的CrO3变为绿色的Cr2(SO4)3,酒精被完全氧化为CO2,则其离子方程式为4CrO3+C2H5OH+12H+=4Cr3++2CO2↑+9H2O.
(5)由于CrO3和K2Cr2O7均易溶于水,所以电镀废水的排放是造成铬污染的主要原因,某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳级,槽中盛放含铬废水,原理示意图如图2:
①A为电源正极,阳极区溶液中发生的氧化还原反应为6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O.
②已知电解后阳极区溶液中c(Fe3+)为2.0×10-13mol•L-1,则c(Cr3+)浓度为3.0×10-6.(已知KsP[Fe(OH)3]=4.0×10-38;Ksp[Cr(OH)3]=6.0×10-31)
分析 (1)根据质量守恒定律,在变化过程中,Cr的质量没有变,计算B中Cr、O原子质量,进而计算计算氧原子和铬原子的个数比确定化学式;
(2)设CrO3的质量为100g,则CrO3中铬元素的质量为100g×$\frac{52}{52+16×3}$=52g,A点时固体的质量为:100g×94.67%=94.67g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为94.67g-52g=42.67g,两者的个数比为$\frac{52}{52}$:$\frac{42.67}{16}$=3:8,所以A点时剩余固体的成分是Cr3O8,同时生成氧气;
(3)CrO3与KOH反应生成与K2CrO4与水;
(4)由题目信息可知,酸性条件下,CrO3和C2H5OH发生氧化还原反应生成Cr2(SO4)3和CO2,由元素守恒可知有水生成,配平书写离子方程式;
(5)①由图可知,酸性条件,右侧生成氢气,发生还原反应,为阴极区,左侧为阳极区,Fe离子放电生成Fe2+,左侧得到几乎不含+6铬的水,生成的Fe2+与Cr2O72-在酸性要进行应生成Cr3+与Fe2+与水;
②根据KsP[Fe(OH)3]及铁离子浓度计算c(OH-),再根据Ksp[Cr(OH)3]计算c(Cr3+).
解答 解:(1)设CrO3的质量为100g,则CrO3中铬元素的质量为100g×$\frac{52}{52+16×3}$=52g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr元素的质量为52g,氧元素的质量为76g-52g=24g,Cr、O原子个数比为$\frac{52}{52}$:$\frac{24}{16}$=2:3,所以B点时剩余固体的成分是Cr2O3,故答案为:Cr2O3;
(2)设CrO3的质量为100g,则CrO3中铬元素的质量为100g×$\frac{52}{52+16×3}$=52g,A点时固体的质量为100g×94.67%=94.67g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为94.67g-52g=42.67g,两者的个数比为$\frac{52}{52}$:$\frac{42.67}{16}$=3:8,所以A点时剩余固体的成分是Cr3O8,同时生成氧气,反应方程式为6CrO3$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3O8+O2↑,
故答案为:6CrO3$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3O8+O2↑;
(3)CrO3溶解于KOH溶液,反应生成与K2CrO4与水,反应方程式为:CrO3+2KOH=K2CrO4+H2O,故答案为:CrO3+2KOH=K2CrO4+H2O;
(4)由题目信息可知,酸性条件下,CrO3和C2H5OH发生氧化还原反应生成Cr2(SO4)3和CO2,由元素守恒可知有水生成,反应离子方程式为:4CrO3+C2H5OH+12H+=4Cr3++2CO2↑+9H2O,
故答案为:4CrO3+C2H5OH+12H+=4Cr3++2CO2↑+9H2O;
(5)①由图可知,酸性条件,右侧生成氢气,发生还原反应,为阴极区,左侧为阳极区,A为电源的正极,Fe离子放电生成Fe2+,左侧得到几乎不含+6铬的水,生成的Fe2+与Cr2O72-在酸性要进行应生成Cr3+与Fe2+与水,发生的氧化还原反应为:6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O,
故答案为:正;6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O;
②电解后阳极区溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{2.0×1{0}^{-13}}}$=mol/L,溶液中c(Cr3+)=$\frac{6.0×1{0}^{-31}}{{c}^{3}(O{H}^{-})}$mol/L=$\frac{6.0×1{0}^{-31}}{\frac{4.0×1{0}^{-38}}{2.0×1{0}^{-13}}}$mol/L=3.0×10-6mol/L,故答案为:3.0×10-6.
点评 本题考查较综合,涉及无机物推断、氧化还原反应、电解池原理、溶度积有关计算等知识点,同时考查学生获取信息、加工信息能力,需要学生具备扎实的基础,题目难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案| A. | 原电池放电过程中,负极质量一定减轻,正极质量一定增加 | |
| B. | 常温下浓硫酸与铝不反应,所以常温下可用铝制贮罐贮运浓硫酸 | |
| C. | 8NH3(g)+6NO2(g)=7N2(g)+12 H2O(g)△H<0该反应一定能自发进行 | |
| D. | 提取海带中的碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好 |
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
| A. | 12.4 g白磷中含有共价键数为0.4 NA | |
| B. | 3Fe+4H2O(g)=Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 | |
| C. | 在1 L 0.1 mol/L碳酸钠溶液中阴离子总数等于0.1 NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
| A. | KI溶液中滴加稀硫酸:4H++4I-+O2=2I2+2H2O | |
| B. | 过量SO2通入氨水中:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+=Al(OH)3↓ | |
| D. | 氨水滴入AgNO3溶液中至沉淀完全:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
| A. | 常温常压下为气体 | B. | 能发生氧化反应 | ||
| C. | 不能发生取代反应 | D. | 易溶于水 |
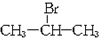 ;
;