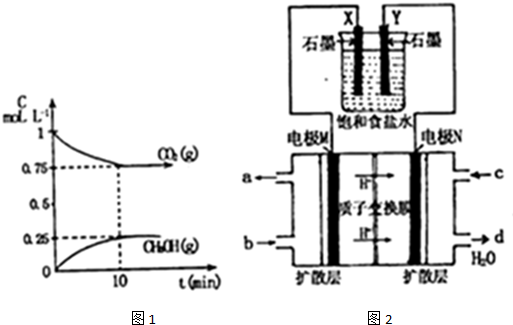
题目内容
4.在一支试管里加入10mL 0.10mol/LCuSO4溶液,再向其中滴加BaCl2溶液至恰好完全反应,反应的离子方程式为Ba2++SO42-=BaSO4↓;经过滤,得到沉淀和滤液.(1)有白色沉淀生成,而滤液为蓝色现象,说明CuSO4电离出来的Cu2+没有参与上述化学反应;
(2)为说明BaCl2电离出来的Cl-没有参与上述化学反应,可以继续进行如下实验作:向滤液中滴加AgNO3溶液,再滴加稀硝酸,
看到的现象是:有白色沉淀生成,且沉淀不溶解.
分析 CuSO4溶液中滴加BaCl2溶液,反应生成硫酸钡沉淀和氯化铜,滤液为蓝色,滤液中的溶质为氯化铜,以此来解答.
解答 解:10mL 0.10mol/LCuSO4溶液,再向其中滴加BaCl2溶液至恰好完全反应,反应的离子方程式为Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓;
(1)观察到有白色沉淀生成,而滤液为蓝色,则CuSO4电离出来的Cu2+没有参与上述化学反应,故答案为:有白色沉淀生成,而滤液为蓝色;
(2)若向滤液中滴加AgNO3溶液,再滴加稀硝酸,观察到有白色沉淀生成,且沉淀不溶解,则说明BaCl2电离出来的Cl-没有参与上述化学反应,故答案为:向滤液中滴加AgNO3溶液,再滴加稀硝酸;有白色沉淀生成,且沉淀不溶解.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的实质为及解答的关键,侧重复分解反应及离子检验的考查,题目难度不大.

练习册系列答案
相关题目
20.下列离子方程式正确的是( )
| A. | KI溶液中滴加稀硫酸:4H++4I-+O2=2I2+2H2O | |
| B. | 过量SO2通入氨水中:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+=Al(OH)3↓ | |
| D. | 氨水滴入AgNO3溶液中至沉淀完全:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
1.下列装置能达到实验目的是( )
| A. |  如图所示装置完成实验室制氨气 | |
| B. |  如图所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. |  如图所示装置除去HCl中含有的少量Cl2 | |
| D. |  如图所示装置可用于分离二氧化锰和二氯化锰 |
5.下列有关实验的现象与对应结论均正确的是 ( )
| 选项 | 实验 | 现象 | 结论 |
| A | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有强氧化性 |
| B | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有较多水 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向AgCl悬浊液中滴加KI溶液 | 白色沉淀变黄色 | AgI的溶解度大于AgCl |
| A. | A | B. | B | C. | C | D. | D |
9.某有机物m g与过量钠反应生成V L气体.该有机物m g与过量小苏打反应,生成相同状况下的气体V L.则此有机物可能是下列中的( )
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
16.短周期元素X、Y、Z、W、M的原子序数依次增大,X、Z同主族,Z、W、M同周期,其 中X与Y能形成两种物质,且常温下均为液体.W的氧化物既能溶于强碱溶液,又能溶于 X、M形成的水溶液.已知W与M形成的物质在178°C时升华.下列说法不正确的是( )
| A. | Z、W、M的原子半径由大到小的顺序为Z>W>M | |
| B. | M分别与Z、W所形成的物质的晶体类型相同 | |
| C. | X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键 | |
| D. | 将Z2Y在空气中加热可得到Z2Y2 |
13.从下列实验事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷自燃而氮气在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
14.下列实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向FeCl3溶液中滴加NaOH溶液 | 制备Fe(OH)3胶体 |
| B | 将CO2通入水玻璃溶液中 | 证明C元素的非金属性大于Si |
| C | 向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤 | 除去苯中混有的苯酚 |
| D | 淀粉与稀H2SO4共热,再加入银氨溶液水浴加热 | 验证淀粉水解产物有无还原性 |
| A. | A | B. | B | C. | C | D. | D |