题目内容
20.将27.8gFeSO4•7H2O溶于水配成100mL FeSO4溶液,从中取出20mL,此20mL溶液中C(Fe2+)为1mol/L,m(FeSO4) 为3.04g,将取出的20mL溶液加水稀释到100mL,则稀释后溶液中C(FeSO4)为0.2mol/L.分析 根据n=$\frac{m}{M}$,c=$\frac{n}{V}$计算,溶质的物质的量浓度与体积无关,稀释过程中物质的量不变,结合c=$\frac{n}{V}$计算.
解答 解:n=$\frac{m}{M}$=$\frac{27.8g}{278g/mol}$=0.1mol,所以c(Fe2+)=c( FeSO4)=$\frac{0.1mol}{0.1L}$=1 mol/L,n=1 mol/L×0.02L=0.02mol,所以m=nM=0.02mol×152g/mol=3.04g,根据20ml×1 mol/L=100mL×c(FeSO4),解之得:c(FeSO4)=0.2 mol/L,故答案为:1 mol/L;3.04g; 0.2 mol/L.
点评 本题考查物质的量浓度的有关计算,难度中等,根据稀释过程中溶质的物质的量不变计算混合后溶液的浓度是关键.

练习册系列答案
相关题目
10.将下列物质的量浓度相等的溶液等体积混合有白色沉淀生成,加入过量稀硝酸后,沉淀消失并放出气体,再加入AgNO3溶液又有白色沉淀生成的是( )
| A. | 碳酸钠与氢氧化钙 | B. | 碳酸钠与氯化钡 | ||
| C. | 碳酸氢钙与氢氧化钠 | D. | 硫酸钠与氯化钡 |
15.对反应SO2+I2+2H2O=H2SO4+2HI 中描述正确的是( )
| A. | 反应中的氧化剂是SO2,还原剂是I2 | |
| B. | 反应中SO2被氧化,I2被还原 | |
| C. | 反应中有1mol电子转移,就有0.5mol SO2被还原 | |
| D. | H2SO4既是氧化产物,又是还原产物 |

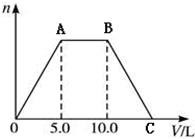 向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答:
向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答: ,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目:
,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目: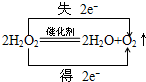 .
.