题目内容
5.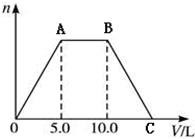 向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答:
向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答:(1)AB段表示的离子方程式是:CO2+2OH-=CO32-+H2O、CO32-+CO2+H2O=2HCO3-
(2)整个反应过后溶液的导电能力较反应前基本不变(强、弱、基本不变)
(3)C点时通入V(CO2)为15L
(4)混合溶液中NaOH和Ca(OH)2的物质的量之比为1:1.
分析 向NaOH和Ca(OH)2的混合稀溶液中通入CO2,开始产生沉淀,故A点之前发生反应:CO2+Ca(OH)2=CaCO3↓+H2O,A~B之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,B~C之间发生反应:CaCO3+H2O+CO2═Ca(HCO3)2,由方程式可知生成碳酸钙沉淀与碳酸钙溶解消耗二氧化碳的体积相等,可知C点二氧化碳的体积,根据氢氧化钙、氢氧化钠消耗二氧化碳体积计算溶液中Ca(OH)2和NaOH的物质的量之比,由此分析解答.
解答 解:(1)A~B之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,所以离子方程式为:CO2+2OH-=CO32-+H2O、CO32-+CO2+H2O=2HCO3-,故答案为:CO2+2OH-=CO32-+H2O、CO32-+CO2+H2O=2HCO3-;
(2)整个反应过后溶液变成碳酸氢钠和碳酸氢钙,离子浓度基本不变,所以整个反应过后溶液的导电能力基本不变,故答案为:基本不变;
(3)B~C之间发生反应:CaCO3+H2O+CO2═Ca(HCO3)2,由方程式可知生成碳酸钙沉淀与碳酸钙溶解消耗二氧化碳的体积相等,所以C点的体积为15,
故答案为:15;
(4)消耗二氧化碳的量Ca(OH)2和NaOH的物质的量相等,然后根据相同条件下体积之比等于物质的量之比,A点之前发生反应:CO2+Ca(OH)2=CaCO3↓+H2O,A~B之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,所以NaOH和Ca(OH)2的物质的量之比为1:1,
故答案为:1:1.
点评 本题考查物质之间的反应,明确物质的性质、及反应先后顺序是解本题关键,难度较大.

| A. | 强电解质溶液一定比弱电解质溶液导电能力强 | |
| B. | BaSO4是弱电解质 | |
| C. | 酒精、CO2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
| A. | 化学反应过程中,分子的种类一定发生改变 | |
| B. | 已知2A(g)+B(g)?C(g)+D(s)△H<0,则该反应一定能自发进行 | |
| C. | 有化学键发生断裂,就有化学反应的发生 | |
| D. | 放热反应的反应速率一定比吸热反应的反应速率大 |
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铝片插入硝酸汞溶液中:Al+Hg2+=Al3++Hg | |
| C. | Ba(OH)2与稀H2SO4反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 盐酸除铁锈:O2-+2H+═H2O |
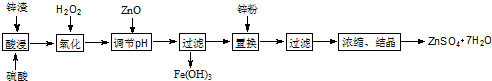
(1)酸浸时温度和时间对锌浸出率的影响如表.
| 酸浸时间/h | 酸浸温度/℃ | 锌浸出率/% |
| 2 | 80 | 87 |
| 2 | 90 | 95 |
| 2 | 110 | 85.3 |
| 3 | 95 | 94.5 |
| 2.5 | 95 | 94 |
 综合考虑,反应的最佳温度和时间是2h、90℃
综合考虑,反应的最佳温度和时间是2h、90℃(2)氧化时也可改通空气,其原因是4Fe2++O2+4H+═4Fe3++2H2O.(用离子方程式表示)
(3)加入锌粉的目的是除去Cu2+.
(4)检验Fe3+是否除尽的方法是取第一次过滤后的滤液少许于试管中,加KSCN溶液,若溶液无血红色出现,则Fe3+已除尽.
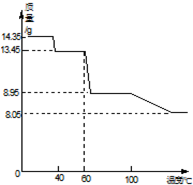
(5)取14.35gZnSO4•7H2O加热分解,加热过程中,固体质量随温度的变化如图所示.写出从60℃到80℃时发生的反应ZnSO4•6H2O$\frac{\underline{\;△\;}}{\;}$ZnSO4•H2O+5H2O.(用化学方程式表示)
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | N[CO(g)]mol | N[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | y | 0.3 |
②保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.2mol/L.
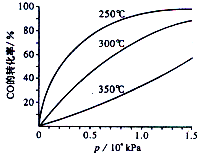
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下平衡转化率与压强的关系如图所示.该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强的理由是在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本.
(3)CH4和H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,通过计算求CH4的平衡转化率(保留2位小数).
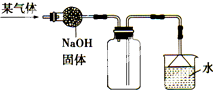 如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( )
如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( )