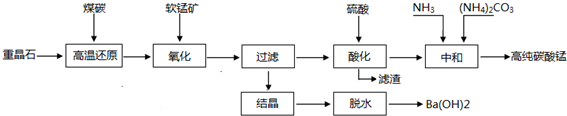
题目内容
15.对反应SO2+I2+2H2O=H2SO4+2HI 中描述正确的是( )| A. | 反应中的氧化剂是SO2,还原剂是I2 | |
| B. | 反应中SO2被氧化,I2被还原 | |
| C. | 反应中有1mol电子转移,就有0.5mol SO2被还原 | |
| D. | H2SO4既是氧化产物,又是还原产物 |
分析 SO2+I2+2H2O=H2SO4+2HI中,S元素的化合价由+4价升高为+6价,I元素的化合价由0降低为-1价,以此来解答.
解答 解:A.S元素的化合价升高,I元素的化合价降低,则氧化剂为I2,还原剂为SO2,故A错误;
B.氧化剂为I2,被还原,而还原剂为SO2,被氧化,故B正确;
C.由反应可知,转移2mol电子时1molSO2被氧化,则有1mol电子转移,就有0.5mol SO2被氧化,故C错误;
D.S失去电子被氧化,则H2SO4是氧化产物,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握发反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析与应用能力的考查,题目难度不大.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
5.下列关于指定粒子的构成叙述中,正确的是( )
| A. | 37Cl与39K所含的中子数不同 | |
| B. | 12C和14C是不同的核素,但质子数相等 | |
| C. | H3O+与OH-的质子数和电子数均相同 | |
| D. | Mg2+与O2-的核外电子排布不相同 |
6.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别 | |
| D. | 相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多,消耗HCl的物质的量之比为2:1 |
3.向某密闭容器中充入2molCO和1molH2O(g),发生反应:CO+H2O(g)=CO2+H2,当反应达到平衡时,CO的体积分数为W,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于W的是( )
| A. | 2mol CO+0.5mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1.5mol CO+0.5mol H2O(g)+0.4mol CO2+0.4mol H2 | |
| C. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 |
10.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因是( )
| A. | 青雾中的小水滴颗粒大小约为10-9m~10-7m | |
| B. | 光是一种胶体 | |
| C. | 雾是一种胶体 | |
| D. | 发生丁达尔效应 |
7.对于可逆反应:mA(g)+nB(g)?xC(g)+yD(s)△H=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如图所示,下列判断正确的是( )


| A. | △H>0,m+n>x+y | B. | △H<0,m+n>x+y | C. | △H<0,m+n>x | D. | △H>0,m+n<x |
4.下列化学方程式中,电子转移不正确的是( )
| A. | 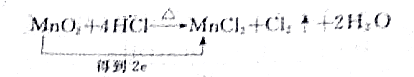 | |
| B. | 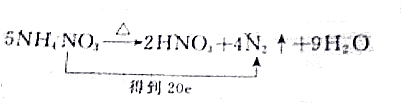 | |
| C. | 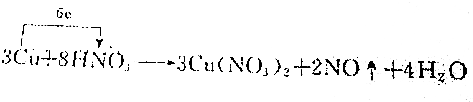 | |
| D. |  |