题目内容
11.把19.2g 的Cu放入足量的稀硝酸中,微热至Cu完全反应.已知:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O求:
(1)生成的NO在标准状况下的体积
(2)作为氧化剂的硝酸的物质的量.
分析 n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,
(1)根据转移电子守恒计算生成NO在标况下体积;
(2)根据转移电子守恒计算作氧化剂硝酸物质的量.
解答 解:n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,
(1)根据转移电子守恒得生成NO在标况下体积=$\frac{0.3mol×2}{5-2}×22.4L/mol$=4.48L,
答:生成NO在标况下体积是4.48L;
(2)根据转移电子守恒得作氧化剂硝酸物质的量=$\frac{0.3mol×2}{5-2}$=0.2 mol,
答:作氧化剂硝酸的物质的量是0.2mol.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量关系是解本题关键,注意转移电子守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
1.分离和提纯下列混合物,将合理的方法填入下列空格内:
常见的物质分离和提纯的方法有:过滤,蒸发,升华,萃取,蒸馏,加热分解,结晶等.
| 序号 | 混合物 | 方法 |
| 1 | 海水中提取饮用水 | |
| 2 | 提取碘水中的碘 | |
| 3 | 从含少量氯化钠的硝酸钾溶液中提取硝酸钾 | |
| 4 | 从KNO3溶液中分离AgCl颗粒; | |
| 5 | 除去生石灰中混有少量的碳酸钙 |
2.下列变化中需加入氧化剂才能实现的是( )
| A. | H2SO4→BaSO4 | B. | Fe3+→Fe2+ | C. | CuO→Cu | D. | Fe→Fe2+ |
6.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别 | |
| D. | 相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多,消耗HCl的物质的量之比为2:1 |
16.下列对化学反应的说法正确的是( )
| A. | 化学反应过程中,分子的种类一定发生改变 | |
| B. | 已知2A(g)+B(g)?C(g)+D(s)△H<0,则该反应一定能自发进行 | |
| C. | 有化学键发生断裂,就有化学反应的发生 | |
| D. | 放热反应的反应速率一定比吸热反应的反应速率大 |
3.向某密闭容器中充入2molCO和1molH2O(g),发生反应:CO+H2O(g)=CO2+H2,当反应达到平衡时,CO的体积分数为W,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于W的是( )
| A. | 2mol CO+0.5mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1.5mol CO+0.5mol H2O(g)+0.4mol CO2+0.4mol H2 | |
| C. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 |
9.某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
Ⅰ合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是;催化剂、吸水剂简述混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
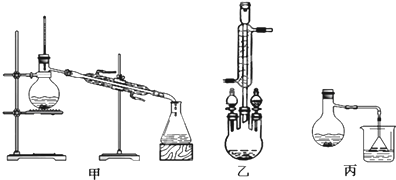
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用装置乙(填“甲”或“乙”或“丙”).
Ⅱ粗产品的精制
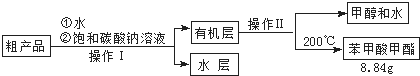
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ操作Ⅱ.
(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65%.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是;催化剂、吸水剂简述混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用装置乙(填“甲”或“乙”或“丙”).

Ⅱ粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ操作Ⅱ.

(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65%.