题目内容
【题目】燃煤烟气中含有大量NOx、CO2、CO和SO2,经处理可获得重要的化工原料。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=+1 160.0 kJ·mol-1
①反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH3=___________kJ·mol-1。
②若反应中还原NOx至N2,消耗标准状况下4.48L CH4,则反应过程中转移的电子总数为_____。
(2)利用烟气中分离所得的CO2、CO与H2按一定比例混合在催化剂的作用下合成甲醇,发生的主要反应如下:
反应1: CO(g)+2H2(g)=CH3OH(g)ΔH1=-99.0 kJ·mol-1
反应2: CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH2=+483.0 kJ·mol-1
反应3: CO2(g)+H2(g)=CO(g)+H2O(g)ΔH3=+384.0 kJ·mol-1
反应体系中CO平衡转化率(α)与温度和压强的关系如图所示。
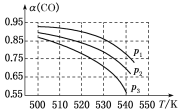
①α(CO)随温度升高而减小的原因是____________________。
②图中的p1、p2、p3由大到小的顺序为__________________。
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2在碱性环境中反应的离子方程式:________________。
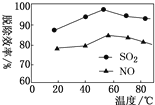
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是:____________________。
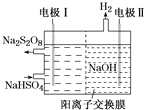
③从复合吸收剂吸收烟气后的废液中可回收得到NaHSO4,低温电解NaHSO4水溶液可制备工业上常用的强氧化剂Na2S2O8,原理如图所示。电解时电极Ⅰ的电极反应式为______________。
【答案】+293 1.6NA 升高温度时,反应1为放热反应,平衡向左移动,使得体系中CO的量增大;反应3为吸热反应,平衡向右移动,又使得CO的量增大 p1>p2>p3 4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O SO2易溶于水,NO难溶于水,吸收剂中SO2浓度明显比NO大 SO42--2e-=S2O82-或2HSO4--2e-=S2O82-+2H+
【解析】
(1)①依据已知的热化学方程式利用盖斯定律解答;
②若反应中还原NOx至N2,消耗标准状况下4.48LCH4,CH4被氧化为CO2,碳元素化合从-4价升高为+4价,可结合甲烷的物质的量,可计算反应中转移电子数目;
(2)①由图可知,压强一定时,随温度的升高,CO的转化率降低,根据升高温度对反应①、③的影响,进行分析CO转化率变化原因;
②相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子式减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大;
(3)①废气中的NO与NaClO2反应,NaClO2具有氧化性,NO具有还原性,发生氧化还原反应,生成NO3-、SO42-,据此写出反应的离子方程式;
②烟气中SO2和NO的水溶性存在明显差异,影响了复合剂对烟气中SO2、NO脱除效率;
③电解池的I极上NaHSO4生成Na2S2O8的过程是氧化过程,说明I极为阳极,据此书写电极反应式。
(1)①已知:(i)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0 kJ/mol;
(ii). CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=+1160.0 kJ/mol
由盖斯定律[(i)+ (ii)]÷2,整理可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH3=+293kJ/mol;
②还原NOx至N2,消耗标准状况下4.48LCH4,n(CH4)=4.48L÷22.4L/mol=0.2mol,根据反应过程中电子转移数目相等,可知在整个过程中转移的电子总数N(e-)=0.2mol×8NA=1.6NA;
(2)①由图可知,压强一定时,随温度的升高,CO的转化率减小,说明反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大;反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,则随温度升高,CO的转化率减小;
②相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:p1>p2>p3;
(3)①废气中的NO与NaClO2反应,NaClO2具有氧化性,NO具有还原性,发生氧化还原反应,生成NO3-、SO42-,则此反应的离子方程式为4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O;
②SO2易溶于水,而NO难溶于水,导致吸收剂中SO2浓度明显比NO大,则SO2比NO脱除效率高;
③I极上NaHSO4失电子发生氧化反应生成Na2S2O8的电极反应式为SO42--2e-=S2O82-或2HSO4--2e-=S2O82-+2H+。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】某学习小组研究大小相同、过量的去膜镁条与40mL0.1mol·L1的盐酸和醋酸分别反应,相同条件下测得气体体积与反应时间关系如下表所示:
气体读数/mL | 5 mL | 10 mL | 15 mL | 20 mL | …… | 45 mL |
A瓶(醋酸)/s | 155 | 310 | 465 | 565 | …… | 865 |
B瓶(盐酸)/s | 7 | 16 | 30 | 64 | …… | 464 |
下列说法不正确的是( )
A.0~5mL时,A与B反应速率不同的原因是c(H+)不同所致
B.5~10mL时,A瓶平均反应速率为![]() mL·s1
mL·s1
C.0~20mL时,A瓶反应速率增大,可能是温度升高所致
D.0~45mL时段内,镁与盐酸反应的速率始终大于镁与醋酸反应的速率