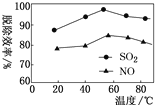
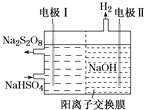
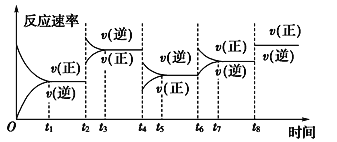
题目内容
【题目】某学习小组研究大小相同、过量的去膜镁条与40mL0.1mol·L1的盐酸和醋酸分别反应,相同条件下测得气体体积与反应时间关系如下表所示:
气体读数/mL | 5 mL | 10 mL | 15 mL | 20 mL | …… | 45 mL |
A瓶(醋酸)/s | 155 | 310 | 465 | 565 | …… | 865 |
B瓶(盐酸)/s | 7 | 16 | 30 | 64 | …… | 464 |
下列说法不正确的是( )
A.0~5mL时,A与B反应速率不同的原因是c(H+)不同所致
B.5~10mL时,A瓶平均反应速率为![]() mL·s1
mL·s1
C.0~20mL时,A瓶反应速率增大,可能是温度升高所致
D.0~45mL时段内,镁与盐酸反应的速率始终大于镁与醋酸反应的速率
【答案】D
【解析】
A.醋酸是弱酸,相同浓度的盐酸、醋酸中氢离子浓度不同, 0~5mL时,A与B反应速率不同的原因是c(H+)不同所致,故A正确;
B. 5~10mL时,A瓶平均反应速率=![]()
![]() mL·s1,故B正确;
mL·s1,故B正确;
C. 酸与金属反应放热,0~20mL时,A瓶反应速率增大,可能是温度升高所致,故C正确;
D. 20~45mL时段内,镁与盐酸用时400s,镁与醋酸用时300s,镁与醋酸反应的速率大于镁与盐酸反应的速率,故D错误。
选D。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目