题目内容
【题目】(1)M能层上有________个能级,有________个轨道,作为内层最多可容纳________个电子,作为最外层时,最多可含有________个未成对电子。
(2)E原子核外电子占有9个轨道,且具有1个未成对电子,E离子结构示意图是____________。
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是________,F2-的电子排布式是______________。
【答案】3 9 18 3  13 1s22s22p6
13 1s22s22p6
【解析】
(1)M能层有3个能级,分别是![]() 、
、![]() 和
和![]() ,一共有
,一共有![]() 个轨道,作为内层时,根据
个轨道,作为内层时,根据![]() 的规则能容纳18个电子,而作为最外层时,最多能有3个未成对电子,即
的规则能容纳18个电子,而作为最外层时,最多能有3个未成对电子,即![]() 中有3个未成对的p电子;
中有3个未成对的p电子;
(2)占有九个轨道且有1个未成对电子,只能是![]() 的电子排布,即氯元素,其离子结构为
的电子排布,即氯元素,其离子结构为 ;
;
(3)G是正三价的,则考虑为铝元素,其原子序数为13,而F只能是氧,![]() 的电子排布式为
的电子排布式为![]() 。
。

【题目】Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第____周期第____族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
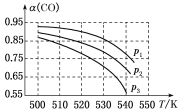
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物pCP,探究有关因素对该降解反应速率的影响。
[实验设计]控制pCP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | ____ | ____ | ____ | ____ |
③ | ____ | 298 | 10 | 6.0 | 0.30 |
[数据处理]实验测得pCP的浓度随时间变化的关系如图:

(2)请根据图中实验①曲线,列式并计算降解反应在50~150 s内的反应速率:________。
[解释与结论]
(3)实验①②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:____________。
(4)实验③得出的结论是:pH等于10时,_________________________。