题目内容
16.已知电离平衡常数:H2CO3>HClO>HCO3-,下列有关离子反应及其应用的叙述$\underset{不}{•}$$\underset{正}{•}$$\underset{确}{•}$的是( )| A. | 将足量SO2通入含Fe2+、Cl-、Ba2+、Al3+的溶液中,四种离子仍能大量共存 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 氢氧化铁与足量的HBr溶液反应的离子方程式:Fe(OH)2+3H+═Fe2++3H2O | |
| D. | 将100mL1mol•L-1的FeCl3溶液与足量NaS固体充分反应,生成沉淀10.4g |
分析 A.四种离子之间不反应,都不与二氧化硫反应;
B.电离平衡常数:HClO>HCO3-,反应生成的是碳酸氢根离子;
C.氢氧化铁与溴化氢反应生成溴化铁和水;
D.生成的沉淀为氯化亚铁和S单质,根据电子守恒计算出生成S沉淀的物质的量,再根据铁元素守恒计算出生成氯化亚铁的物质的量,最后根据m=nM计算出生成沉淀的总质量.
解答 解:A.Fe2+、Cl-、Ba2+、Al3+之间不发生反应,都不与SO2反应,在溶液中能够大量共存,故A正确;
B.电离平衡常数:HClO>HCO3-,则酸性HClO>HCO3-,向NaClO溶液中通入少量二氧化碳,反应生成次氯酸和碳酸氢根离子,正确的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C.氢氧化铁与足量的HBr溶液反应生成溴化铁和水,正确的离子方程式:Fe(OH)3+3H+═Fe3++3H2O,故C错误;
D.100mL1mol•L-1的FeCl3溶液中含有氯化铁的物质的量为:1mol/L×0.1L=0.1mol,0.1mol铁离子完全反应转化成亚铁离子得到电子的物质的量为:0.1mol×(3-2)=0.1mol,根据电子守恒,生成S单质的物质的量为:$\frac{0.1mol}{2}$=0.05mol,其质量为:32g/mol×0.05mol=1.6g;由于硫化钠足量,泽尔亚铁离子完全转化成FeS,则生成硫化亚铁的质量为:88g/mol×0.1mol=8.8g,所以生成沉淀的总质量为:1.6g+8.8g=10.4g,故D正确;
故选BC.
点评 本题考查离子共存、离子方程式书写、氧化还原反应的计算等知识,题目难度中等,注意掌握离子方程式的书写原则,明确离子共存的条件,D为易错点,注意生成的沉淀为FeS和S的混合物.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | 常温下金属A一定能与水反应,B一定不能与水反应 | |
| B. | A与B用导线连接后放入酒精中,一定形成原电池 | |
| C. | A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生 | |
| D. | 由A与B形成的原电池,A一定是负极,B一定是正极 |
| A. | 0.1mol Na2O2固体中阳离子与阴离子的总数为0.4NA | |
| B. | 46g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol Fe与硫恰好完全反应时,转移电子数一定为3NA | |
| D. | 标准状况下,1mol CH4与过量的氯气发生取代反应,生成CH3Cl气体的体积约为22.4L |
| A. | 0.008889 | B. | 0.08000 | C. | 0.1200 | D. | 0.2400 |
| A. | 已知C(石墨,s)=C(金刚石,s)△H>O,则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)═2H20(1)△H=-571.6kJ•mol-1,则氢气的燃烧热为-285.8kJ•mol-1 | |
| C. | 含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该条件下稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═H3COOHNa(aq)+H2O(l)H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1:2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
| A. | Cu是还原剂,被腐蚀 | B. | Fe2+是氧化产物 | ||
| C. | 该反应是置换反应 | D. | 该反应属于离子反应 |
| A. | 使用石蕊试纸检验气体需要现用蒸馏水湿润 | |
| B. | 使用容量瓶要先检查是否漏水 | |
| C. | 使用锥形瓶进行酸碱中和滴定要先用待测液润洗 | |
| D. | 使用棕色瓶保存浓硝酸 |


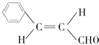 .
. .
. .
.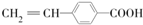 .
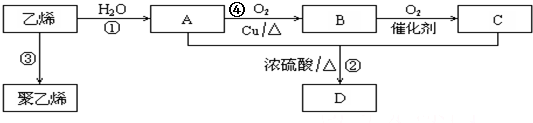
.
 ;
;