题目内容
13.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 0.1mol Na2O2固体中阳离子与阴离子的总数为0.4NA | |
| B. | 46g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol Fe与硫恰好完全反应时,转移电子数一定为3NA | |
| D. | 标准状况下,1mol CH4与过量的氯气发生取代反应,生成CH3Cl气体的体积约为22.4L |
分析 A.过氧化钠是有钠离子和过氧根离子构成计算;
B.NO2和N2O4的最简式相同,只需要计算46g NO2中原子数;
C.铁与硫反应生成硫化亚铁;
D.氯气与甲烷反应发生取代反应,为可逆反应,同时有多个反应发生.
解答 解:A.0.1mol Na2O2晶体物质的量为0.1mol,阳离子Na+为0.2mol,阴离子O22-物质的量为0.1mol,阳离子与阴离子总数为0.3NA,故D错误;
B.NO2和N2O4的最简式相同,只需要计算46g NO2中氧原子数=$\frac{46g}{46g/mol}$×2×NA=2NA,故B正确;
C.1mol Fe与硫恰好完全反应时,转移电子数一定为2NA,故C错误;
D.氯气与甲烷反应发生取代反应,为可逆反应,同时有多个反应发生,所以标准状况下,1mol CH4与过量的氯气发生取代反应,生成CH3Cl气体的体积小于22.4L,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,熟悉公式是关键,注意物质的组成、结构.

练习册系列答案
相关题目
1.下列关于有机化合物的说法正确的是( )
| A. | 由甲烷的氯代物有4种,可推知乙烷的氯代物有6种 | |
| B. | 乙烯和苯蒸气都能使溴水褪色,不能鉴别乙烯和苯蒸气 | |
| C. | 淀粉、油脂、蔗糖在一定条件下都能发生水解 | |
| D. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
8.华法林(Warfarin,如图)是一种鼠药.该分子的立体中心数目为( )
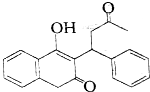

| A. | 0 | B. | 1 | C. | 2 | D. | 3 |
18.下列说法正确的是( )
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 离子化合物中只含有离子键 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子键一定存在于化合物中 |
16.已知电离平衡常数:H2CO3>HClO>HCO3-,下列有关离子反应及其应用的叙述$\underset{不}{•}$$\underset{正}{•}$$\underset{确}{•}$的是( )
| A. | 将足量SO2通入含Fe2+、Cl-、Ba2+、Al3+的溶液中,四种离子仍能大量共存 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 氢氧化铁与足量的HBr溶液反应的离子方程式:Fe(OH)2+3H+═Fe2++3H2O | |
| D. | 将100mL1mol•L-1的FeCl3溶液与足量NaS固体充分反应,生成沉淀10.4g |
17.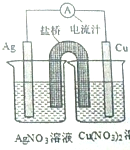 某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
 某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )| A. | 实验过程中,左右两侧烧杯中,NO3-浓度变化情况分别为不变,增大 | |
| B. | 实验过程中,取出盐桥,该原电池也能继续工作 | |
| C. | 若开始使用U形铜管代替盐桥,装置中有电流产生,铜管质量不变 | |
| D. | 若开始时用U形铜管代替盐桥,装置中无电流产生 |
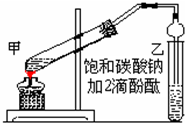 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: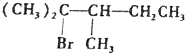 ,试推导A的构造式,用“*”标出手性碳原子,并用系统命名法命名.
,试推导A的构造式,用“*”标出手性碳原子,并用系统命名法命名.