题目内容
8.用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu=2Fe2++Cu2+.下列有关说法正确的是( )| A. | Cu是还原剂,被腐蚀 | B. | Fe2+是氧化产物 | ||
| C. | 该反应是置换反应 | D. | 该反应属于离子反应 |
分析 反应Cu+2Fe3+═2Fe2++Cu2+中,Cu元素化合价升高,被氧化,Cu为还原剂,Fe元素化合价降低,被还原,Fe3+为氧化剂,以此解答.
解答 解:A.Cu元素化合价升高,被氧化,为还原剂,故A正确;
B.Fe元素化合价降低,被还原,Fe2+是还原产物,故B错误;
C.生成物中没有单质,不是置换反应,故C错误;
D.该反应有离子参加,是离子反应,故D正确.
故选AD.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.已知电离平衡常数:H2CO3>HClO>HCO3-,下列有关离子反应及其应用的叙述$\underset{不}{•}$$\underset{正}{•}$$\underset{确}{•}$的是( )
| A. | 将足量SO2通入含Fe2+、Cl-、Ba2+、Al3+的溶液中,四种离子仍能大量共存 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 氢氧化铁与足量的HBr溶液反应的离子方程式:Fe(OH)2+3H+═Fe2++3H2O | |
| D. | 将100mL1mol•L-1的FeCl3溶液与足量NaS固体充分反应,生成沉淀10.4g |
3.据报道,科学家成功制得了CO2的原子晶体(以下用M表示).下列关于M的推断正确的是( )
| A. | M具有很高的熔沸点 | |
| B. | M容易汽化,可用作制冷材料 | |
| C. | M和干冰互为同素异形体 | |
| D. | M是由C原子和O原子按1:2的比例所组成的平面网状的晶体 |
17.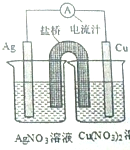 某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
 某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )| A. | 实验过程中,左右两侧烧杯中,NO3-浓度变化情况分别为不变,增大 | |
| B. | 实验过程中,取出盐桥,该原电池也能继续工作 | |
| C. | 若开始使用U形铜管代替盐桥,装置中有电流产生,铜管质量不变 | |
| D. | 若开始时用U形铜管代替盐桥,装置中无电流产生 |
18.分子式为C5H10O2且属于酯的同分异构体有( )
| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
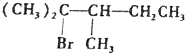 ,试推导A的构造式,用“*”标出手性碳原子,并用系统命名法命名.
,试推导A的构造式,用“*”标出手性碳原子,并用系统命名法命名.