题目内容
10.下列说法正确的是( )| A. | 已知:O═O键键能为a kJ/mol、H-H键键能为b kJ/mol、水蒸气中H-O键能为c kJ/mol.又知:H2O(g)═H2O(l)△H=-d kJ/mol.则反应2H2 (g)+O2(g)═2H2O(l) 的△H为:(a+2b-4c-2d)kJ/mol | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测常温下NaHA溶液的pH.若常温下pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 常温下pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa)>c(NaOH) | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
分析 A、△H=反应物键能之和-生成物键能之和;
B、NaHA溶液若PH>7说明溶液呈碱性,说明对应酸一定为弱酸,若pH<7可能对应酸是强酸,也可能对应酸是弱酸;
C、对应酸的酸性越弱,酸根离子的水解程度越强,溶液的pH越大,已知酸性:c(CH3COOH)>c(C6H5OH)>c(HCO3-),据此判断pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液的浓度关系;
D、氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,溶液中c(Cl-)越大,c(Ag+)越小.
解答 解:A、由H2O(g)=H2O(l)△H=-d kJ/mol,水蒸气中H-O键能为c kJ/mol,设液态水中H-O键能为xkJ/mol,则△H=2c-2x=-d,解得:x=0.5(2c+d),反应2H2(g)+O2(g)=2H2O(l) 的△H=2×b+a-4×[0.5(2c+d)]=(a+2b-4c-2d)kJ/mol,故A正确;
B、NaHA溶液若pH>7说明溶液呈碱性,说明对应酸一定为弱酸,若pH<7可能对应酸是强酸,如硫酸氢钠,也可能对应酸是弱酸,如亚硫酸氢钠,故B错误;
C、酸性大小为:c(CH3COOH)>c(C6H5OH)>c(HCO3-),则等浓度的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液的pH大小为:c(CH3COONa)<c(C6H5ONa)<c(Na2CO3),则pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液的浓度关系为:c(CH3COONa)>c(C6H5ONa)>c(Na2CO3),而氢氧化钠是强碱,所以则溶液浓度大小关系:c(CH3COONa)>c(C6H5ONa)>c(Na2CO3)>c(NaOH)故C错误;
D、氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,①蒸馏水中没有氯离子、②0.1mol/L盐酸中c(Cl-)=0.1mol/L,③0.1 mol/L氯化镁溶液c(Cl-)=0.2mol/L、④0.1mol/L硝酸银溶液中c(Ag+)=0.1mol/L,溶液中c(Ag+)为④>①>②>③,故D错误.
故选:A.
点评 本题考查强弱电解质、弱电解质的电离、盐类水解、溶度积及相关计算等,难度中等,注意把握强弱电解质关键是电解质是否完全电离.

| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
| A. | 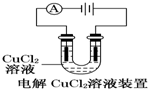 装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝 | |
| B. | 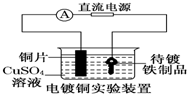 装置中待镀铁制品应与电源正极相连 | |
| C. |  装置中电子由b极流向a极 | |
| D. |  装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
| A. | 两种气体被完全吸收,并生成BaSO4沉淀 | |
| B. | 两种气体被完全吸收,生成BaSO3和BaSO4沉淀 | |
| C. | 两种气体均不能被吸收,没有沉淀生成 | |
| D. | 只有一种气体被吸收,生成BaSO4沉淀 |
| A. | CO32-、OH-、Cl-、NH4+ | B. | Na+、K+、HSO3-、Cl-. | ||
| C. | K+、Na+、S2-、NO3-. | D. | Na+、Al3+、Cl-、K+ |