题目内容
19.在含有AlO2-的溶液中,下列离子可以大量共存的是( )| A. | CO32-、OH-、Cl-、NH4+ | B. | Na+、K+、HSO3-、Cl-. | ||
| C. | K+、Na+、S2-、NO3-. | D. | Na+、Al3+、Cl-、K+ |
分析 A.氢氧根离子、偏铝酸根离子都与铵根离子反应;
B.亚硫酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀和亚硫酸根离子;
C.四种离子之间不反应,都不与偏铝酸根离子反应;
D.偏铝酸根离子与铝离子发生双水解反应生成氢氧化铝沉淀.
解答 解:A.OH-、AlO2-与NH4+反应,在溶液中不能大量共存,故A错误;
B.HSO3-、AlO2-之间反应生成氢氧化铝沉淀和亚硫酸根离子,在溶液中不能大量共存,故B错误;
C.K+、Na+、S2-、NO3-之间不发生反应,且都不与AlO2-反应,在溶液中能够大量共存,故C正确;
D.Al3+、AlO2-之间发生双水解反应生成氢氧化铝沉淀,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如本题中能够与偏铝酸根离子反应的离子不能共存.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
9.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的还原性为H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | L、M、R的最高价氧化物的水化物两两之间均能反应 | |
| D. | 离子半径:L2+<R2- |
10.下列说法正确的是( )
| A. | 已知:O═O键键能为a kJ/mol、H-H键键能为b kJ/mol、水蒸气中H-O键能为c kJ/mol.又知:H2O(g)═H2O(l)△H=-d kJ/mol.则反应2H2 (g)+O2(g)═2H2O(l) 的△H为:(a+2b-4c-2d)kJ/mol | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测常温下NaHA溶液的pH.若常温下pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 常温下pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa)>c(NaOH) | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
7.已知阿伏加德罗常数的值为NA,下列说法正确的是( )
| A. | 1 mol CH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 7.2g C5H12含有的C-C键的数目为0.5NA | |
| C. | 常温常压条件下,14 g N2和CO的混合气体含有的分子数目为0.5NA | |
| D. | 2mol H2O2完全分解生成1mol O2,转移的电子数为4NA |
14.伞形酮可用作荧光指示剂和酸碱指示剂.其合成方法为:
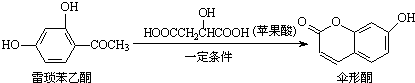
下列有关这三种物质的说法正确的是( )
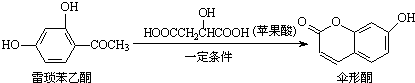
下列有关这三种物质的说法正确的是( )
| A. | 雷琐苯乙酮所有碳原子不可能共平面 | |
| B. | 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应 | |
| C. | 1 mol雷琐苯乙酮跟足量H2反应,最多消耗3 mol H2 | |
| D. | 1 mol伞形酮与足量NaOH溶液反应,最多消耗3 mol NaOH |
11.碲(Te)是与O、S同族的元素,位于第五周期.据此,推断碲的相关性质错误的是( )
| A. | 碲的单质在常温下是固态 | B. | 碲的常见化合价是-2、+4、+6 | ||
| C. | 碲可能作半导体材料 | D. | 碲的氢化物H2Te很稳定 |
13.下列叙述中不正确的是 ( )
| A. | 卤素单质的颜色按Cl2、Br2、I2的顺序逐渐变深 | |
| B. | Cl2、Br2、I2的氧化性逐渐增强 | |
| C. | 氯、溴、碘的原子半径或离子半径随电子层数的增多而增大 | |
| D. | 氯气易液化,溴单质易挥发,碘单质易升华 |