题目内容
20.有一种白色固体化合物X,当它与NaOH溶液共热时,放出气体可使湿润的酚酞试液变红色,这种溶液用硝酸酸化后,再加入氯化钡溶液时,能生成沉淀,则X可能是( )| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
分析 由于白色化合物与碱溶液反应产生使酚酞试液变红色的气体,所以该物质属于铵盐;又该溶液用硝酸酸化后,再加入氯化钡溶液时,能生成沉淀,所以产生的沉淀为硫酸钡,故对应的阴离子可以是硫酸根离子,也可以是亚硫酸根离子.
解答 解:由于白色化合物与碱溶液反应产生使酚酞试液变红色的气体,所以该物质属于铵盐,又该溶液用硝酸酸化后,再加入氯化钡溶液时,能生成沉淀,NH4Cl、(NH4)2CO3、(NH4)3PO4 不能生成沉淀,所以产生的沉淀为硫酸钡,故对应的阴离子可以是硫酸根离子,也可以是亚硫酸根离子,则X为选项中的(NH4)2SO3;
故选A.
点评 本题考查了铵盐性质、亚硫酸根离子的还原性,掌握离子性质是解题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.一定条件下,充分燃烧一定量的丁烷(C4H10) 生成的二氧化碳气体和液态水,放出热量为Q kJ(Q>0),经测定完全吸收生成的二氧化碳需消耗5mol•L-1的KOH溶液100ml,恰好生成正盐,则此条件下反应丁烷燃烧热的△H为( )
| A. | +8QkJ/mol | B. | +16Q kJ/mol | C. | -8Q kJ/mol | D. | -16Q kJ/mol |
11.下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是( )
| A. | CH3Cl | B. |  | ||
| C. |  | D. | 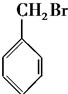 |
15.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据上表中的实验现象完成下列问题:
(1)实验1、2的Al所作的电极分别是D
A.负极,负极 B.正极,正极 C.负极,正极 D.正极,负极
(2)写出实验5中的电极反应式和电池总反应方程式.
负极Cu-2e-=Cu2+;
正极4H++2NO3-+2e-=2NO2↑+2H2O;
电池总反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Cu | 浓硝酸 | 偏向Al |
(1)实验1、2的Al所作的电极分别是D
A.负极,负极 B.正极,正极 C.负极,正极 D.正极,负极
(2)写出实验5中的电极反应式和电池总反应方程式.
负极Cu-2e-=Cu2+;
正极4H++2NO3-+2e-=2NO2↑+2H2O;
电池总反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
12.下列说法中不正确的是 ( )
| A. | 容量瓶、分液漏斗、滴定管在使用府前都需要检杏是否漏水,可以用相同的方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的1/2 | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体一半透膜法分离提纯;悬浊液一过滤分离,本质上就是依椐所分离粒子的直径大小选择具有合适孔径的“筛子” |
9.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的还原性为H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | L、M、R的最高价氧化物的水化物两两之间均能反应 | |
| D. | 离子半径:L2+<R2- |
10.下列说法正确的是( )
| A. | 已知:O═O键键能为a kJ/mol、H-H键键能为b kJ/mol、水蒸气中H-O键能为c kJ/mol.又知:H2O(g)═H2O(l)△H=-d kJ/mol.则反应2H2 (g)+O2(g)═2H2O(l) 的△H为:(a+2b-4c-2d)kJ/mol | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测常温下NaHA溶液的pH.若常温下pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 常温下pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa)>c(NaOH) | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |

 .
.