题目内容
15.(1)如图1是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b、c两点对应的元素分别为O、Si(填元素符号).(2)将CrCl3•6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在.
①上述溶液中,不存在的微粒间作用力是A、C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
②[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是如果Cr3+采取sp3杂化,则只有4个成键轨道,无法形成6个配位键.
(3)下面关于晶体的说法不正确的是C.
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
(4)硼化镁晶体在39K时呈超导性.在硼化镁晶体中,镁原子和硼原子是分层排布的,图2是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上.则硼化镁的化学式为MgB2.
(5)铁的金属密堆积方式为体心立方结构,结构如图3所示. 则晶胞中铁原子的配位数为8.若铁原子的半径为r pm,写出该堆积方式的空间利用率的表达式(不要求算出结果)$\frac{2×\frac{4}{3}π{r}^{3}}{(\frac{4r}{\sqrt{3}})^{3}}$.
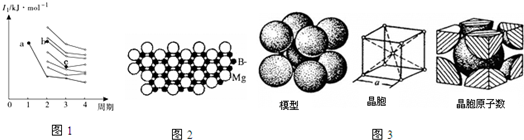
分析 (1)同一周期元素中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,同一主族元素中,第一电离能随着原子序数增大而减小;
(2)①溶液中非金属元素之间存在共价键、含有孤电子对和含有空轨道的原子之间存在配位键、分子之间存在范德华力;
②如果Cr3+采取sp3杂化,则只有4个成键轨道,无法形成6个配位键;
(3)A.分子晶体的相对分子质量越大,熔沸点越大;
B.键长越短,共价键越强,硬度越大;
C.金属离子的电荷越大、半径越小,其熔点越大;
D.离子半径越小、离子键越强,则晶格能越大;
(4)该晶体微观结构的透视图中,每个Mg原子周围有6个B原子,每个B原子为3个Mg原子共用,利用均摊法计算解答;
(5)体心立方结构的配位数为8;利用均摊法计算晶胞的结构.
解答 解:(1)同一周期元素中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,同一主族元素中,第一电离能随着原子序数增大而减小,所以b是O元素、c是Si元素,
故答案为:O;Si;
(2)①A.电解质在水溶液里电离出阴阳离子,所以该离子中不存在离子键,故选;
B.水分子或[Cr(H2O)5Cl]2+中,非金属元素之间都存在共价键,故不选;
C.该溶液中不存在金属键,故选;
D.[Cr(H2O)5Cl]2+中Cr原子和水分子中的O原子之间存在配位键,故不选;
E.溶液中水分子之间存在范德华力,故不选;
故选A、C;
②[Cr(H2O)5Cl]2+中Cr3+的配位数是6,如果Cr3+采取sp3杂化,则只有4个成键轨道,无法形成6个配位键,所以Cr3+的轨道杂化方式不是sp3,
故答案为:如果Cr3+采取sp3杂化,则只有4个成键轨道,无法形成6个配位键;
(3)A.分子晶体的相对分子质量越大,熔沸点越大,则晶体熔点由低到高顺序为CF4<CCl4<CBr4<CI4,故A正确;
B.键长越短,共价键越强,硬度越大,键长C-C<C-Si<Si-Si,则硬度由大到小为金刚石>碳化硅>晶体硅,故B正确;
C.金属离子的电荷越大、半径越小,其熔点越大,则熔点由高到低为Al>Mg>Na,故C错误;
D.离子半径越小、离子键越强,则晶格能越大,F、Cl、Br、I的离子半径在增大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,故D正确;
故选C;
(4)该晶体微观结构的透视图中,每个Mg原子周围有6个B原子,每个B原子为3个Mg原子共用,于一个Mg原子的B原子为$\frac{1}{3}$×6=2,Mg、硼原子个数比为1:2,故硼化镁的化学式为MgB2,
故答案为:MgB2;
(5)铁的金属密堆积方式为体心立方结构,即体心位置有一个铁原子,上下八个顶点各一个,晶胞中铁原子的配位数为8;体心立方中含有1+8×$\frac{1}{8}$=2个铁原子,晶胞中铁原子的体积为:2×$\frac{4}{3}$×π×r3,体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:$\frac{4}{\sqrt{3}}$r,晶胞体积为:($\frac{4r}{\sqrt{3}}$)3,空间利用率为:$\frac{2×\frac{4}{3}π{r}^{3}}{(\frac{4r}{\sqrt{3}})^{3}}$×100%;
故答案为:8; $\frac{2×\frac{4}{3}π{r}^{3}}{(\frac{4r}{\sqrt{3}})^{3}}$.
点评 本题考查了第一电离能、化学键、原子杂化方式的判断、铁的晶胞等知识点,根据价层电子对互斥理论确定中心原子杂化方式,第一电离能大小比较是高频考点、易错点,体心立方晶胞的计算为该题难点,题目难度中等.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. |  鼻子闻 | B. |  嘴巴吹 | C. |  耳朵听 | D. |  眼睛看 |
| A. | 已知:O═O键键能为a kJ/mol、H-H键键能为b kJ/mol、水蒸气中H-O键能为c kJ/mol.又知:H2O(g)═H2O(l)△H=-d kJ/mol.则反应2H2 (g)+O2(g)═2H2O(l) 的△H为:(a+2b-4c-2d)kJ/mol | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测常温下NaHA溶液的pH.若常温下pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 常温下pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa)>c(NaOH) | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
| A. | 0.8mol•L-1 | B. | 0.72mol•L-1 | C. | 0.1mol•L-1 | D. | 0.036mol•L-1 |
| A. | 1 mol CH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 7.2g C5H12含有的C-C键的数目为0.5NA | |
| C. | 常温常压条件下,14 g N2和CO的混合气体含有的分子数目为0.5NA | |
| D. | 2mol H2O2完全分解生成1mol O2,转移的电子数为4NA |
| A. | 硫磺 | B. | 纯碱 | C. | 烧碱 | D. | 细沙 |
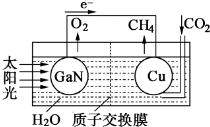
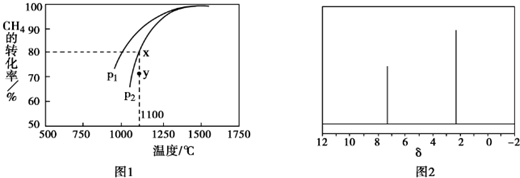
 .
.