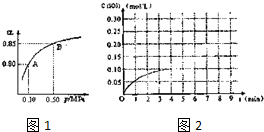
题目内容
18.(1)①根据图1示,写出反应的热化学方程式:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol.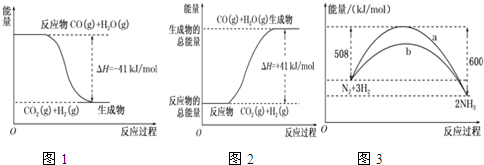
②根据图2所示情况,判断下列说法中正确的是B.
A.其热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)
△H=+41kJ/mol
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41kJ/mol
(2)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是S(s)+O2(g)=SO2(g)△H=-296.8kJ/mol.
(3)图3是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
分析 (1)①图象分析反应物能量高于生成物可知为放热反应,标注物质聚集状态和对应反应的焓变写出热化学方程式;
②图象分析生成物能量高于反应物可知为吸热反应,则根据图象该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,又气态水变成液态水还要放热,据此判断;
(2)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(3)图象分析可知是1molN2与和3molH2完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,据此写出反应的热化学方程式.
解答 解:(1)图象分析可知为放热反应,反应的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;
②图象分析生成物能量高于反应物可知为吸热反应,则根据图象该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,
A、将反应的反应物与生成物弄反了,故A错误;
B、生成物的能量比反应物的能量高,故该反应为吸热反应,故B正确;
C、生成物的能量比反应物的能量高,故该反应为吸热反应,故C错误;
D、因为气态水变成液态水还要放热,当H2O为液态时,其反应热值大于41kJ/mol,故D错误;
故选:B;
(2)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(3)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.
点评 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,注意键能计算焓变的方法,题目难度中等,注重基础知识的考查.

部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的还原性为H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | L、M、R的最高价氧化物的水化物两两之间均能反应 | |
| D. | 离子半径:L2+<R2- |
| A. | 逐滴加入氨水中,所得溶液中c(H+)逐渐增大 | |
| B. | 继续通入过量C12,①、②均向右移动,溶液pH减小 | |
| C. | 加入CaCO3悬浊液中,CaCO3的溶解平衡向右移动 | |
| D. | 加入一定量NaOH溶液中,所得溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
| A. |  鼻子闻 | B. |  嘴巴吹 | C. |  耳朵听 | D. |  眼睛看 |
| A. | 已知:O═O键键能为a kJ/mol、H-H键键能为b kJ/mol、水蒸气中H-O键能为c kJ/mol.又知:H2O(g)═H2O(l)△H=-d kJ/mol.则反应2H2 (g)+O2(g)═2H2O(l) 的△H为:(a+2b-4c-2d)kJ/mol | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测常温下NaHA溶液的pH.若常温下pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 常温下pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa)>c(NaOH) | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
| A. | 1 mol CH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 7.2g C5H12含有的C-C键的数目为0.5NA | |
| C. | 常温常压条件下,14 g N2和CO的混合气体含有的分子数目为0.5NA | |
| D. | 2mol H2O2完全分解生成1mol O2,转移的电子数为4NA |