题目内容
【题目】二氧化硫是常见的有刺激性气味的硫氧化物,是大气主要污染物之一。某学习兴趣小组设计如下所示装置制取SO2并探究其性质。

(1)仪器a的名称是________,装置B中观察到的现象是________。
(2)装置C中氯水褪色,证明SO2具有________(填“氧化性”“还原性”或“漂白性”)。
(3)装置D中出现淡黄色沉淀,发生反应的化学方程式为________。
(4)某同学认为在A、B间应增加F装置,该装置的作用是________。
(5)装置E能否证明SO2是酸性氧化物________(填“能”或“不能”),理由是________。
(6)硫的氧化物是形成酸雨的主要物质之一。某小组采集酸雨样品,每隔一段时间测定一次样品pH,得数据如下:
时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH变小的主要原因是________(用发生反应的化学方程式解释)。某同学在48h后偶然测得样品的pH又减小到3.9,导致样品pH再次减小的原因可能是________。
【答案】分液漏斗 品红溶液褪色 还原性 SO2+2H2S=3S↓+2H2O 安全瓶或防倒吸 不能 SO2与NaOH反应无明显现象 2H2SO3+O2=2H2SO4或2SO2+O2+2H2O=2H2SO4 水分蒸发使c(H+)浓度增大
【解析】
由实验装置分析可知,A为浓硫酸和Cu在加热的条件下制取SO2气体的装置,发生反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,B为验证SO2的漂白性的装置,C为验证SO2的还原性的装置,D为验证SO2氧化性的装置,E为尾气处理装置,据此分析解答。
CuSO4+SO2↑+2H2O,B为验证SO2的漂白性的装置,C为验证SO2的还原性的装置,D为验证SO2氧化性的装置,E为尾气处理装置,据此分析解答。
(1)根据仪器构造可知,仪器a为分液漏斗,根据上述分析可知,A装置制取SO2气体,由于SO2具有漂白性,因此SO2能使B装置中的品红溶液褪色,故答案为:分液漏斗;品红溶液褪色;
(2)装置C中氯水褪色,说明氯水中的Cl2被还原,证明SO2具有还原性,故答案为:还原性;
(3)SO2具有氧化性,可与H2S发生归中反应生成S单质,反应的化学方程式为SO2+2H2S=3S↓+2H2O,故答案为:SO2+2H2S=3S↓+2H2O;
(4)SO2易溶于水,为防止倒吸,应在A、B间应增加F装置,保证实验的安全性,故答案为:安全瓶或防倒吸;
(5)由于SO2与NaOH反应无明显现象,因此不能通过装置E来证明SO2是酸性氧化物,故答案为:不能;SO2与NaOH反应无明显现象;
(6)由于SO2与水反应生成的H2SO3具有还原性,易被空气中的氧气氧化生成酸性更强的H2SO4,反应方程式为2H2SO3+O2=2H2SO4或2SO2+O2+2H2O=2H2SO4,所以酸雨样品随着时间的推移pH会变小,同时水分蒸发使c(H+)浓度增大,pH会再次减小,故答案为:2H2SO3+O2=2H2SO4或2SO2+O2+2H2O=2H2SO4;水分蒸发使c(H+)浓度增大。

【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
【题目】用“吸收—电解”循环法脱除烟气中的SO2,可减少对大气的污染。室温下,电解液K再生的装置如图所示,其中电解液的pH随![]() 变化的关系见下表,下列对此判断正确的是
变化的关系见下表,下列对此判断正确的是
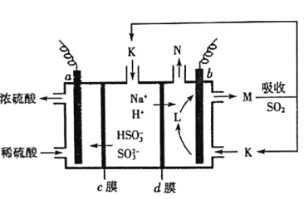
电解液 | n(SO32-):n(HSO3-) | pH |
K | 9:91 | 6.2 |
L | 1:1 | 7.2 |
M | 91:9 | 8.2 |
A.当电解液呈中性时溶液中:![]()
B.再生液M吸收SO2主反应的离子方程式为:![]()
C.HSO3-在b极发生的电极反应式为:![]()
D.若产生标准状况下2.24L气体N,则d膜上共通过0.2mol阳离子