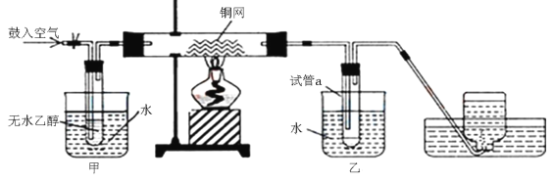
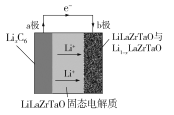
��Ŀ����
����Ŀ��Cu3N�������õĵ�ѧ��ѧ���ܣ��ڵ��ӹ�ҵ�����պ�������������ͨѶ�����Լ���ѧ��ҵ�������У������Ź㷺�ġ���������ľ����á�
(1)Nλ�����ڱ��е�________����________�塣
(2)C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ________________��
(3)Cu+�ĵ����Ų�ʽΪ________________________������������Һ�в��ȶ����ɷ����绯��Ӧ����Cu 2+��Cu����CuO�ڸ����»�ֽ��Cu2O���Դӽṹ�ǶȽ�������CuOΪ�λ�����Cu2O________________________________________��
(4)��Cu�Ĵ������£��Ҵ��ɱ���������Ϊ��ȩ����ȩ������̼ԭ�ӵ��ӻ���ʽ��________����ȩ������H��C��O�ļ���________�Ҵ������е�H��C��O�ļ���(������������������������С����)��
(5)[Cu(H2O)4]2+�е�����H2O��Cl-ȡ�������ֲ�ͬ�Ľṹ����[Cu(H2O)4]2+�ĽṹΪ________�Ρ�
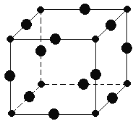
(6)Cu3N�ľ����ṹ��ͼ��N3������λ��Ϊ________��Cu+�뾶Ϊa pm��N3���뾶Ϊbpm��Cu3N���ܶ�________________g/cm3��(�����ӵ���Ϊ������NA��ʾ)(1pm��10��10 cm)
���𰸡��� VA N>O>C 1s22s22p63s23p63d10��[Ar]3d10 Cu+��3d����ϵ���ȫ����ṹ�ȶ� sp2��sp3 ���� ƽ�������� 6 ![]()
��������
��1��Nλ�ڵڶ�����VA�壻
��2��ͬ���ڴ������ҵ�һ�����ܳ��������ƣ�����A>��A����A>��A��������Ԫ�ص�һ�����ܴ�С˳����N>O>C��
��3��Cuλ�ڵ�������IB�壬�����Ų�ʽΪ[Ar]3d104s1�����Cu���ĵ����Ų�ʽΪ1s22s22p63s23p63d10��[Ar]3d10��CuO��Cu�ԣ�2�ۣ�Cu2���۵����Ų�ʽΪ3d9��Cu2O��Cu�ԣ�1�ۣ�Cu���۵����Ų�ʽΪ3d10������ȫ�����ṹ�ȶ������Ը�����CuO�����ɸ��ȶ���Cu2O��
��4����ȩ�Ľṹ��ʽΪCH3CHO����CH3�ϵ�CΪsp3����CHO��CΪsp2�ӻ�����ȩH��C��O��CΪsp2�ӻ����н�Ϊ120�����Ҵ�H��C��O��CΪsp3�ӻ����н�Ϊ109��28�������ǰ���Ǵ��ں��ߣ�
��5������H2O��Cl��ȡ�������ֲ�ͬ�Ľṹ���Ƴ�[Cu(H2O)4]2���ĽṹΪƽ�������Σ�
��6���þ����д���ĸ���Ϊ12��1/4=3��С��ĸ���Ϊ8��1/8=1�������仯ѧʽ��С��ΪN3��������ΪCu�������ݾ�����N3������λ��Ϊ6���þ������ⳤΪ(2a��2b)pm=(2a��2b)��10��10cm�����������Ϊ(2a��2b)3��10��30cm3������������Ϊ![]() ���������ܶ�Ϊ
���������ܶ�Ϊ![]() ����64��3+14��g��[(2a��2b)3��10��30cm3]=
����64��3+14��g��[(2a��2b)3��10��30cm3]=![]() g/cm3��
g/cm3��

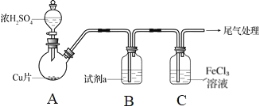
����Ŀ�����������dz������д̼�����ζ����������Ǵ�����Ҫ��Ⱦ��֮һ��ijѧϰ��ȤС�����������ʾװ����ȡSO2��̽�������ʡ�
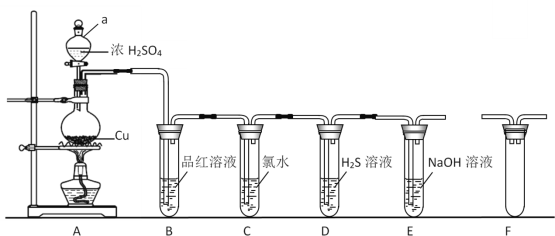
(1)����a��������________��װ��B�й۲쵽��������________��
(2)װ��C����ˮ��ɫ��֤��SO2����________(����������������ԭ��������Ư������)��
(3)װ��D�г��ֵ���ɫ������������Ӧ�Ļ�ѧ����ʽΪ________��
(4)ijͬѧ��Ϊ��A��B��Ӧ����Fװ�ã���װ�õ�������________��
(5)װ��E�ܷ�֤��SO2������������________(������������������)��������________��
(6)������������γ��������Ҫ����֮һ��ijС��ɼ�������Ʒ��ÿ��һ��ʱ��ⶨһ����ƷpH�����������£�
ʱ�� | ��ʼ | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
������ƷpH��С����Ҫԭ����________(�÷�����Ӧ�Ļ�ѧ����ʽ����)��ijͬѧ��48h��żȻ�����Ʒ��pH�ּ�С��3.9��������ƷpH�ٴμ�С��ԭ�������________��