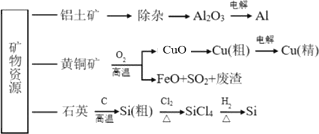
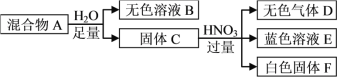题目内容
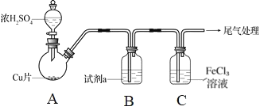
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )

A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
【答案】D
【解析】
从题图中可以看出锌、铜为电极,电解质溶液分别为ZnSO4溶液、CuSO4溶液,自发的氧化还原反应是:Zn+Cu2+=Cu+Zn2+。锌为负极,铜为正极。
A.铜为正极,发生还原反应:Cu2++2e–= Cu,A项正确;
B.电池总反应为Zn+CuSO4=Cu+ZnSO4,改写成离子方程式为:Zn+Cu2+=Zn2+ +Cu,B项正确;
C.在外电路中,电子从负极流出,流入正极,C项正确;
D.盐桥所在的电路为内电路,内电路中阳离子K+移向正极(CuSO4溶液),D项错误;
所以答案选择D项。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
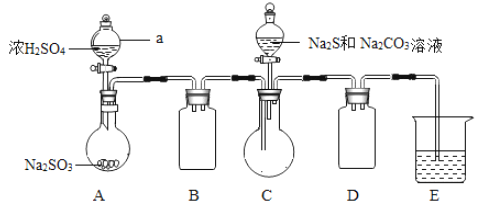
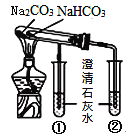
小学生10分钟应用题系列答案【题目】二氧化硫是常见的有刺激性气味的硫氧化物,是大气主要污染物之一。某学习兴趣小组设计如下所示装置制取SO2并探究其性质。

(1)仪器a的名称是________,装置B中观察到的现象是________。
(2)装置C中氯水褪色,证明SO2具有________(填“氧化性”“还原性”或“漂白性”)。
(3)装置D中出现淡黄色沉淀,发生反应的化学方程式为________。
(4)某同学认为在A、B间应增加F装置,该装置的作用是________。
(5)装置E能否证明SO2是酸性氧化物________(填“能”或“不能”),理由是________。
(6)硫的氧化物是形成酸雨的主要物质之一。某小组采集酸雨样品,每隔一段时间测定一次样品pH,得数据如下:
时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH变小的主要原因是________(用发生反应的化学方程式解释)。某同学在48h后偶然测得样品的pH又减小到3.9,导致样品pH再次减小的原因可能是________。