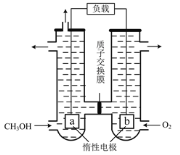
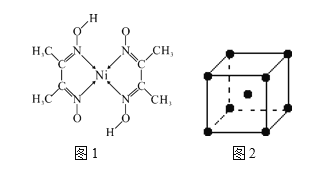
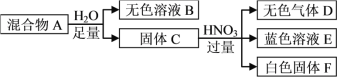题目内容
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.11 g硫化钾和过氧化钾的混合物,含有的离子数目为0.4NA
B.28 g聚乙烯(![]() )含有的质子数目为16NA
)含有的质子数目为16NA
C.将标准状况下224 mLSO2溶于水制成100 mL溶液,H2SO3、HSO3-、SO32-三者数目之和为0.01NA
D.含63 gHNO3的浓硝酸与足量铜完全反应,转移电子数目为0.50NA
【答案】B
【解析】
A.K2S、K2O2的式量是110,11 gK2S、K2O2的混合物的物质的量是![]() =0.1 mol,1 mol K2S含有2 mol K+、1 molS2-,1 mol K2O2中含有2 mol K+、1 molO22-,则0.1 mol混合物中含有离子数目为0.3NA,A错误;
=0.1 mol,1 mol K2S含有2 mol K+、1 molS2-,1 mol K2O2中含有2 mol K+、1 molO22-,则0.1 mol混合物中含有离子数目为0.3NA,A错误;
B.聚乙烯最简式是CH2,式量是14,其中含有的质子数为8,28 g聚乙烯中含有最简式的物质的量是n(CH2)= ![]() =2 mol,则含有的质子数目为2 mol×8×NA/mol=16NA,B正确;
=2 mol,则含有的质子数目为2 mol×8×NA/mol=16NA,B正确;
C.标准状况下224 mLSO2的物质的量是0.01 mol,SO2溶于水反应产生H2SO3,该反应是可逆反应,溶液中存在少量SO2分子,H2SO3是二元弱酸,发生的电离作用分步进行,存在电离平衡,根据S元素守恒可知溶液中S元素存在微粒有SO2、H2SO3、HSO3-、SO32-四种,故H2SO3、HSO3-、SO32-的数目之和小于0.01NA,C错误;
D.63 g HNO3的物质的量为1 mol,若只发生反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O转移电子物质的量为0.50 mol,但是由于铜足量,随着反应的进行,硝酸浓度逐渐变稀,浓硝酸后来变成了稀硝酸,此时发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,若反应只产生NO,转移电子的物质的量为0.75 mol,所以1 mol硝酸与足量的铜反应,转移的电子数大于0.50NA而小于0.75NA,D错误;
故合理选项是B。

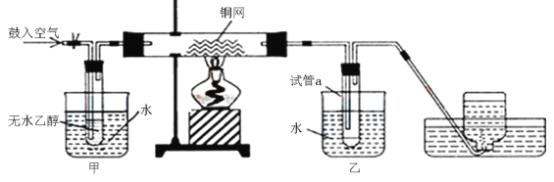
【题目】二氧化硫是常见的有刺激性气味的硫氧化物,是大气主要污染物之一。某学习兴趣小组设计如下所示装置制取SO2并探究其性质。

(1)仪器a的名称是________,装置B中观察到的现象是________。
(2)装置C中氯水褪色,证明SO2具有________(填“氧化性”“还原性”或“漂白性”)。
(3)装置D中出现淡黄色沉淀,发生反应的化学方程式为________。
(4)某同学认为在A、B间应增加F装置,该装置的作用是________。
(5)装置E能否证明SO2是酸性氧化物________(填“能”或“不能”),理由是________。
(6)硫的氧化物是形成酸雨的主要物质之一。某小组采集酸雨样品,每隔一段时间测定一次样品pH,得数据如下:
时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH变小的主要原因是________(用发生反应的化学方程式解释)。某同学在48h后偶然测得样品的pH又减小到3.9,导致样品pH再次减小的原因可能是________。