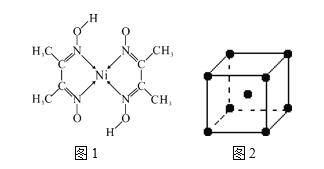
题目内容
【题目】下列离子方程式正确的是
A.铁与盐酸反应:Fe+2H+=Fe3++H2↑
B.氧化镁与稀硫酸反应:O2-+2H+=H2O
C.硫酸铜与氢氧化钡溶液反应:Ba2++SO![]() = BaSO4↓
= BaSO4↓
D.氯气通入氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O
【答案】D
【解析】
A.铁与盐酸反应生成氯化亚铁和氢气,反应的离子方程式是Fe+2H+=Fe2++H2↑,故A错误;
B.氧化镁与稀硫酸反应生成硫酸镁和水,反应的离子方程式是MgO+2H+=Mg2++H2O,故B错误;
C.硫酸铜与氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式是Ba2++2OH-+Cu2++SO![]() = BaSO4↓+Cu(OH)2↓,故C错误;
= BaSO4↓+Cu(OH)2↓,故C错误;
D.氯气通入氢氧化钠溶液中生成氯化钠、次氯酸钠、水,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O,故D正确;
选D。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】铅具有优秀的机械加工性能,可以制备各种性能优良的合金。广泛用于电池制造、机械、船舶工业、以及放射性防护等领域。
(1)铅的主要矿藏形式是方铅矿(PbS)利用其冶炼铅的反应过程如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=akJ·mol-1
PbS(s)+2O2(g)=PbSO4(s) △H=bkJ·mol-1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=ckJ·mol-1
则利用方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为____。
(2)铅也可以采用热还原法冶炼:PbO(s)+CO(g)![]() Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
K | 106.2 | 631 | 17.4 |
①d____0(填>、<或=)
②已知某温度下K=10,向密闭容器中加入足量的Pb和一定量的CO2平衡时,混合气体中CO的体积分数为____。
(3)新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
下列关于该电池的说法正确的是____。
a.充放电时,溶液中Pb2+浓度保持不变
b.放电时,溶液中H+向PbO2极区移动
c.放电时的负极反应式为:Pb-2e-=Pb2+
d.充电时的阳极反应式为:Pb2++4OH--2e-=PbO2+2H2O
(4)河流、湖泊中的铅污染日益被人们重视。已知常温下Pb元素在水中的各种存在形式物质的量分数α和溶液pH的关系如图所示:

向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时的主要离子反应方程式是_____,其平衡常数数值为____。
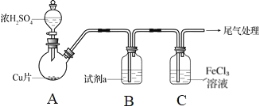
【题目】二氧化硫是常见的有刺激性气味的硫氧化物,是大气主要污染物之一。某学习兴趣小组设计如下所示装置制取SO2并探究其性质。
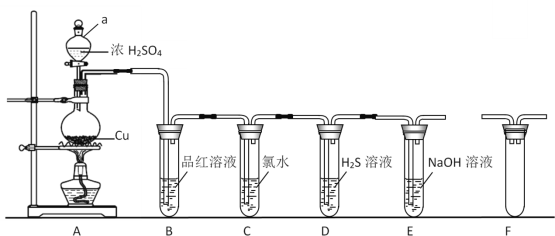
(1)仪器a的名称是________,装置B中观察到的现象是________。
(2)装置C中氯水褪色,证明SO2具有________(填“氧化性”“还原性”或“漂白性”)。
(3)装置D中出现淡黄色沉淀,发生反应的化学方程式为________。
(4)某同学认为在A、B间应增加F装置,该装置的作用是________。
(5)装置E能否证明SO2是酸性氧化物________(填“能”或“不能”),理由是________。
(6)硫的氧化物是形成酸雨的主要物质之一。某小组采集酸雨样品,每隔一段时间测定一次样品pH,得数据如下:
时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH变小的主要原因是________(用发生反应的化学方程式解释)。某同学在48h后偶然测得样品的pH又减小到3.9,导致样品pH再次减小的原因可能是________。