题目内容
【题目】下列化学用语对事实的表述不正确的是( )
A.由Na和Cl形成离子键的过程:![]()
B.常温时,氨气溶于水显碱性:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
C.FeCl3溶液中加入Fe粉,溶液变浅绿:Fe3++Fe=2Fe2+
D.电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
【答案】C
【解析】
A. 由Na和Cl形成离子键的过程中钠失去电子,氯得到电子,其形成过程表示为:![]() ,故A正确;
,故A正确;
B. 常温时,氨气溶于水是可逆反应生成一水合氨,一水合氨部分电离使得溶液显碱性:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,故B正确;
NH4++OH-,故B正确;
C. FeCl3溶液中加入Fe粉,溶液变浅绿:2Fe3++Fe=3Fe2+,故C错误;
D. 电解饱和食盐水,产生黄绿色气体,阳极得到氯气,阴极得到氢气:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,故D正确。
2NaOH+H2↑+Cl2↑,故D正确。
综上所述,答案为C。

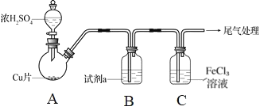
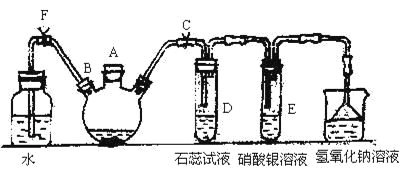
【题目】二氧化硫是常见的有刺激性气味的硫氧化物,是大气主要污染物之一。某学习兴趣小组设计如下所示装置制取SO2并探究其性质。

(1)仪器a的名称是________,装置B中观察到的现象是________。
(2)装置C中氯水褪色,证明SO2具有________(填“氧化性”“还原性”或“漂白性”)。
(3)装置D中出现淡黄色沉淀,发生反应的化学方程式为________。
(4)某同学认为在A、B间应增加F装置,该装置的作用是________。
(5)装置E能否证明SO2是酸性氧化物________(填“能”或“不能”),理由是________。
(6)硫的氧化物是形成酸雨的主要物质之一。某小组采集酸雨样品,每隔一段时间测定一次样品pH,得数据如下:
时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH变小的主要原因是________(用发生反应的化学方程式解释)。某同学在48h后偶然测得样品的pH又减小到3.9,导致样品pH再次减小的原因可能是________。