题目内容
【题目】下表给出了六种元素的相关信息,其中A、B、C、D、E、F为短周期元素,原子序数依次递增。
元素 | 相关信息 |
A | 单质为密度最小的气体 |
B | 元素最高正价与最低负价之和为0 |
D | 可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障 |
E | 存在质量数为23,中子数为12的核素 |
F | 单质F为淡黄色固体 |
根据上述信息填空:
(1)元素D在元素周期表中的位置是____________。E基态原子的电子排布式_______________________。
(2)化合物甲是一种强氧化剂,由元素D和E组成,写出一种甲的用途:_______________,
书写化合物甲与BD2的反应式并标出电子转移情况:_______________。
(3)化合物乙由元素D和F组成,气体乙与A2F反应的化学方程式是______________。化合物乙的危害_______________________。(写一种)
【答案】第二周期VIA族 1S22S22P63S1 供氧剂 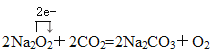 SO2+2H2S=3S+2H2O 形成酸雨等
SO2+2H2S=3S+2H2O 形成酸雨等
【解析】
A元素的单质为密度最小的气体,A是H元素;D元素可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障,D是O元素;E元素存在质量数为23,中子数为12的核素,E的质子数是11,E是Na元素;单质F为淡黄色固体,F是S元素;元素最高正价与最低负价之和为0,B是ⅣA族元素,A、B、C、D、E、F是原子序数依次递增的主族元素,B是C元素、C是N元素。
(1) D是O元素,在元素周期表中的位置是第二周期VIA族。E是Na元素,核外有11个电子,基态原子的电子排布式是1S22S22P63S1;
(2)由元素Na和O组成的化合物甲是一种强氧化剂,则甲是Na2O2,过氧化钠与水、二氧化碳反应放出氧气,做供氧剂;Na2O2与CO2反应生成碳酸钠和氧气,Na2O2中氧元素化合价由-1升高为0、氧元素化合价由-1降低为-2,过氧化钠既是氧化剂又是还原剂,1mol过氧化钠转移1mol电子,电子转移情况为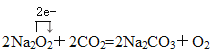 ;
;
(3)化合物乙由元素D和F组成,乙是SO2, A2F是H2S,SO2、H2S生成硫单质和水,反应的化学方程式是SO2+2H2S=3S+2H2O;SO2是酸性氧化物,与水反应生成H2SO3,危害是形成酸雨。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案