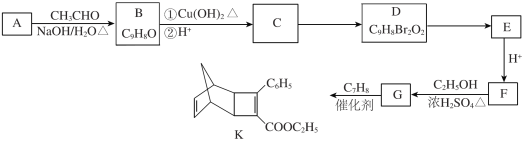
题目内容
【题目】现有19.2克铜与400毫升稀硝酸发生如下反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥表示出电子转移的方向和数目_____________
(2)计算稀硝酸的物质的量浓度_____________
(3)计算产生的气体在标况下的体积_____________
【答案】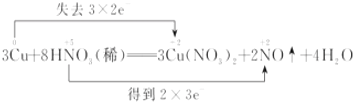 2mol/L 4.48L
2mol/L 4.48L
【解析】
(1)氧化还原反应中得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,根据元素化合价变化标出电子转移的方向和数目;
(2)根据参与反应的铜的质量,结合反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O计算硝酸的物质的量,再利用c=![]() 计算;
计算;
(3)根据参与反应的铜的质量,结合反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O计算产生气体的物质的量,再利用V=nVm计算。
(1)该反应中,硝酸得电子作氧化剂,铜失电子作还原剂,铜对应的产物硝酸铜是氧化产物,该反应中铜失去电子数=3×(2-0)=6,硝酸得电子数=2×(5-2)=6,所以用双线桥法在化学方程式中表示出电子转移的方向和数目为: ;
;
(2) 19.2克铜的物质的量为![]() =0.3mol,根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,3Cu~8HNO3,消耗硝酸的物质的量为0.8mol,则硝酸的浓度=
=0.3mol,根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,3Cu~8HNO3,消耗硝酸的物质的量为0.8mol,则硝酸的浓度=![]() =
=![]() =2mol/L;
=2mol/L;
(3)19.2克铜的物质的量为![]() =0.3mol,根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,3Cu~2NO,则产生NO的物质的量为0.2mol,则NO标况下的体积=0.2mol×22.4L/mol=4.48L。
=0.3mol,根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,3Cu~2NO,则产生NO的物质的量为0.2mol,则NO标况下的体积=0.2mol×22.4L/mol=4.48L。

【题目】碳、氮是重要的非金属元素,在生产、生活中有广泛的应用。
(1)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l) ![]() C6H12O6(s)+6O2(g) △H=+669.62 kJmol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是__________。
C6H12O6(s)+6O2(g) △H=+669.62 kJmol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是__________。
a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
(2)N2O5的分解反应2N2O5(g)![]() 4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5) /(molL﹣1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2) =________molL-1min-1。
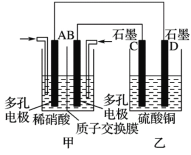
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为_________(填化学式);A电极的电极反应式为_______________________,一段时间后,若乙中需加0.2 mol Cu(OH)2使溶液复原,则转移的电子的物质的量为 _____________。
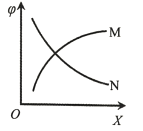
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
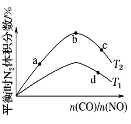
①b点时,平衡体系中C、N原子个数之比接近________________;
②a、b、c三点CO的转化率从大到小的顺序为____________;a、c、d三点的平衡常数从大到小的顺序为__________________。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___________。
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___________。
【题目】下表给出了六种元素的相关信息,其中A、B、C、D、E、F为短周期元素,原子序数依次递增。
元素 | 相关信息 |
A | 单质为密度最小的气体 |
B | 元素最高正价与最低负价之和为0 |
D | 可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障 |
E | 存在质量数为23,中子数为12的核素 |
F | 单质F为淡黄色固体 |
根据上述信息填空:
(1)元素D在元素周期表中的位置是____________。E基态原子的电子排布式_______________________。
(2)化合物甲是一种强氧化剂,由元素D和E组成,写出一种甲的用途:_______________,
书写化合物甲与BD2的反应式并标出电子转移情况:_______________。
(3)化合物乙由元素D和F组成,气体乙与A2F反应的化学方程式是______________。化合物乙的危害_______________________。(写一种)
【题目】汽车尾气中含有CO、NO等有害气体。
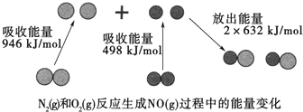
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会________(填“吸收”或“放出”)________kJ能量。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请将表中数据补充完整:a___________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。
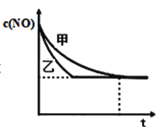
④在容积固定的容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变