题目内容
【题目】镍镉电池是应用广泛的二次电池,其总反应为:
Cd+2NiOOH+2H2O![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
制造密封式镍镉电池的部分工艺如下:
I.Ni(OH)2的制备
以硫酸镍(NiSO4)为原料制备Ni(OH)2的主要过程如下图所示。制备过程中,降低Ni(OH)2沉淀速率,可以避免沉淀团聚,提升电池性能。

已知:Ni2++6NH3H2O[Ni(NH3)6]2++6H2O
(1)操作a是 ____。
(2)制备过程中,需先加氨水,再加过量NaOH,请
①先加氨水的目的是 ___。
②用化学平衡移动原理分析加入NaOH需过量的原因是____。
(3)用无水乙醇代替水洗涤滤渣的优点是_____答出1条即可)。
II.镍镉电池的组装
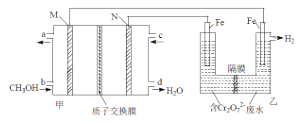
主要步骤:①将Ni(OH)2和Cd(OH)2固定,中间以隔膜隔开(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
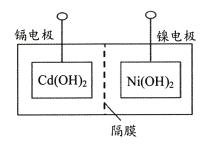
(4)下列对镍镉电池组装和使用的分析正确的是____(填字母序号)。
a.密封镍镉电池可以避免KOH变质
b.镍电极为电池的负极,镉电极为电池的正极
c.电池组装后,应先充电,再使用
III.过度充电的保护
电池充电时,若Cd(OH)2和Ni(OH)2耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的Cd(OH)2可对电池进行过度充电保护,该方法称为镉氧循环法。
(5) Cd(OH)2耗尽后继续充电,镉电极上生成的物质为____。
(6)已知:①隔膜可以透过阴离子和分子:②O2可以与Cd发生反应生成Cd(OH)2。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理:______________________。
【答案】过滤 先加入氨水,可使Ni2+发生反应转化为[Ni(NH3)6]2+,降低溶液中Ni2+的浓度,再加入NaOH
时,可减慢Ni(OH)2的沉降速率 加入NaOH后,溶液中存在两个平衡,平衡①:Ni2+(aq)+2OH-(aq) Ni(OH)2(s),平衡②:Ni2++6NH3H2O[Ni(NH3)6]2++6H2O;OH-过量,使平衡①正向移动,溶液中Ni2+的浓度减小,促使平衡②逆向移动,从而提高Ni(OH)2的产率。 除去Ni(OH)2表面的水分(或乙醇易挥发,有利于真空干燥;降低Ni(OH)2的溶解度) ac H2(或氢气) 过度充电时,由于镉电极Cd(OH)2过量,阴极电极反应为2Cd(OH)2+4e-=2Cd+4OH-,避免生成H2,阳极电极反应为4OH--4e-=O2↑+2H2O;O2通过隔膜进入阴极室,与Cd发生反应2Cd+O2+2H2O=2Cd(OH)2,可继续作为阴极反应物,OH-透过隔膜进入阳极室补充消耗的OH-,使反应循环发生。
【解析】
(1)根据硫酸镍(NiSO4)为原料制备Ni(OH)2的流程图可知:硫酸镍(NiSO4)加氨水得到[Ni(NH3)6]2+ ,再加过量NaOH得到Ni(OH)2,通过过滤可以得到Ni(OH)2粗产品,再经过洗涤干燥得到Ni(OH)2。
(2)通过Cd+2NiOOH+2H2O![]() 2Ni(OH)2+Cd(OH)2 可以判断电池的电极,放电时Cd是负极,镍电极是正极。
2Ni(OH)2+Cd(OH)2 可以判断电池的电极,放电时Cd是负极,镍电极是正极。
(1)从工艺流程图操作a后续使用无水乙醇洗涤滤渣,可逆推分析得知操作a是过滤
(2)从题干已知信息已知:Ni2++6NH3H2O[Ni(NH3)6]2++6H2O可知
①制备过程中,需先加氨水可使Ni2+发生反应转化为[Ni(NH3)6]2+,降低溶液中Ni2+的浓度。②再加入NaOH时,可减慢Ni(OH)2的沉降速率。
(3)用无水乙醇代替水洗涤滤渣的优点是乙醇易挥发,有利于真空干燥,除去Ni(OH)2表面的水分。降低Ni(OH)2的溶解度。
(4)下列对镍镉电池组装和使用的分析正确的是ac
a.密封镍镉电池可以避免空气中二氧化碳与KOH反应生成碳酸钾而变质,a项正确
b.通过Cd+2NiOOH+2H2O![]() 2Ni(OH)2+Cd(OH)2 可以判断电池的电极,放电时Cd是负极,镍电极是正极,b向错误
2Ni(OH)2+Cd(OH)2 可以判断电池的电极,放电时Cd是负极,镍电极是正极,b向错误
c.电池组装后,应先充电,再使用,c项正确
(5) Cd(OH)2耗尽后继续充电,水中氢离子放电生成氢气,所以镉电极上生成的物质为H2
(6) 过度充电时,由于镉电极Cd(OH)2过量,阴极电极反应为2Cd(OH)2+4e-=2Cd+4OH-,避免生成H2,阳极电极反应为4OH--4e-=O2↑+2H2O;O2通过隔膜进入阴极室,与Cd发生反应2Cd+O2+2H2O=2Cd(OH)2,可继续作为阴极反应物,OH-透过隔膜进入阳极室补充消耗的OH-,使反应循环发生。

【题目】下表给出了六种元素的相关信息,其中A、B、C、D、E、F为短周期元素,原子序数依次递增。
元素 | 相关信息 |
A | 单质为密度最小的气体 |
B | 元素最高正价与最低负价之和为0 |
D | 可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障 |
E | 存在质量数为23,中子数为12的核素 |
F | 单质F为淡黄色固体 |
根据上述信息填空:
(1)元素D在元素周期表中的位置是____________。E基态原子的电子排布式_______________________。
(2)化合物甲是一种强氧化剂,由元素D和E组成,写出一种甲的用途:_______________,
书写化合物甲与BD2的反应式并标出电子转移情况:_______________。
(3)化合物乙由元素D和F组成,气体乙与A2F反应的化学方程式是______________。化合物乙的危害_______________________。(写一种)
【题目】汽车尾气中含有CO、NO等有害气体。
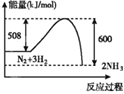
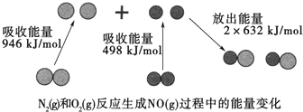
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会________(填“吸收”或“放出”)________kJ能量。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请将表中数据补充完整:a___________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
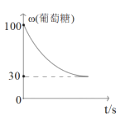
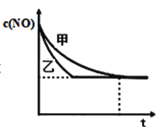
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。
④在容积固定的容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变
【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D