题目内容
15.焦炭可用于制备电石、生产水煤气等.完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是离子晶体;其与水反应的化学方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(2)制备电石还需要用到CaCO3.组成CaCO3的三种元素原子半径按从大到小的顺序排列为Ca>C>O.氧原子的核外电子排布式为1s22s22p4.
(3)与同主族元素Mg相比,Ca的金属性更强(填“强”或者“弱”),能证明这一结论的实验事实是金属钙与水的反应比金属镁剧烈[Ca(OH)2是强碱,Mg(OH)2是弱碱].
用焦炭生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g).
完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是d.(选填编号)
a.容器中的压强不再改变
b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2L的恒容密闭容器中,进行反应,得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | C | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
②下列图象正确的是bc.(选填编号)

分析 (1)由阴阳离子共存的晶体为离子晶体;CaC2和H2O反应生成Ca(OH)2和CH≡CH;
(2)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;O原子核外有8个电子,根据构造原理书写其基态原子核外电子排布式;
(3)同一主族元素,元素的金属性随着原子序数增大而增强,元素的金属性越强,其最高价氧化物的水化物碱性越强、金属与酸或水反应置换出氢气越容易;
(4)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变以及由此引起的一系列物理量不变;
(5)①先计算CO的反应速率,再根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比计算氢气反应速率;
②化学平衡常数只与温度有关,与物质浓度及压强无关;该反应是反应前后气体体积增大的吸热的可逆反应,增大压强平衡向气体体积减小方向移动,升高温度,平衡向吸热反应方向移动.
解答 解:(1)CaC2是由阴阳离子构成的,属于离子晶体;CaC2和H2O反应生成Ca(OH)2和CH≡CH,反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,故答案为:离子晶体;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以这三种元素的原子半径大小顺序是Ca>C>O;O原子核外有8个电子,根据构造原理书写其基态原子核外电子排布式
为1s22s22p4,故答案为:Ca>C>O;1s22s22p4;
(3)同一主族元素,元素的金属性随着原子序数增大而增强,所以金属性Ca>Mg;
元素的金属性越强,其最高价氧化物的水化物碱性越强、金属与酸或水反应置换出氢气越容易,钙与水反应比Mg剧烈、Ca(OH)2是强碱Mg(OH)2是弱碱都说明Ca的金属性大于Mg,
故答案为:强;金属钙与水的反应比金属镁剧烈[Ca(OH)2是强碱,Mg(OH)2是弱碱];
(4)该反应是反应前后气体体积增大、吸热的反应,
a.该反应是反应前后气体体积增大的可逆反应,当容器中的压强不再改变时正逆反应速率相等,该反应达到平衡状态,故a不选;
b.反应前后气体的物质的量增大、质量增大,容器体积不变,当混合气体的密度不再改变时该反应达到平衡状态,故b不选;
c.v正(CO)=v逆(H2O)时,各物质的正逆反应速率相等,该反应达到平衡状态,故c不选;
d.c(CO)=c(H2)时,该反应不一定达到平衡状态,与反应物初始量及转化率有关,故d选;
故选d;
(5)①实验1中以v(CO) 表示的到达平衡时的平均反应速率为=$\frac{\frac{0.008mol}{2L}}{5min}$=8×10-4mol/(L•min),同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,所以氢气平均反应速率为,故答案为:8×10-4mol/(L•min);
②650℃平衡时,c(H2O)=$\frac{0.01-0.008}{2}$mol/L=0.001mol/L、c(H2)=c(CO)=$\frac{0.008}{2}$mol/L=0.004mol/L平衡常数K1=$\frac{0.004×0.004}{0.001}$=0.016,
800℃平衡时,c(H2O)=$\frac{0.02-0.017}{2}$mol/L=0.0015mol/L、c(H2)=c(CO)=$\frac{0.017}{2}$mol/L=0.0085mol/L平衡常数K2=$\frac{0.0085×0.0085}{0.0015}$=0.0482>0.016,
升高温度平衡常数增大,说明正反应是吸热反应;
a.平衡常数只与温度有关,与压强无关,所以压强增大平衡常数不变,故错误;
b.该反应的正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,故正确;
c.该反应的正反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,水的转化率降低,故正确;
d.该反应的正反应是吸热反应,升高温度平衡向正反应方向移动,水的转化率增大,故错误;
故选b、c.
点评 本题考查较综合,涉及平衡常数计算、反应速率计算、平衡状态判断、元素周期律、原子核外电子排布等知识点,这些都是高考高频点,侧重考查学生分析、计算及知识运用能力,注意只有反应前后改变的物理量才能作为平衡状态的判断依据,注意化学平衡常数计算中用物质浓度而不是物质的量计算,这些都是易错点.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | B. | c(Na+)=2c(HS-)+2c(S2-)+c(H2S) | ||
| C. | c(Na+)>c(OH-)>c(HS-)>c(H+) | D. | c(H2S)+c(HS-)+c(H+)=c(OH-) |
| A. | 淀粉、纤维素最终水解产物均为单糖 | |
| B. | 蛋白质最终水解产物是多肽 | |
| C. | 蔗糖、麦芽糖水解产物相同 | |
| D. | 酯在强碱作用下水解生成对应的酸和醇 |
| A. | 过滤时,漏斗下端要紧贴接液烧杯内壁 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干,然后停止加热 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 向Zn与稀硫酸反应的溶液中滴加硫酸铜溶液 | 产生气体的速率加快 | 硫酸铜作该反应的催化剂 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 15种 | B. | 6种 | C. | 4种 | D. | 2种 |
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
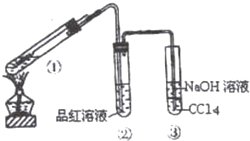 在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.