题目内容
20.下列实验操作、现象和结论均正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 向Zn与稀硫酸反应的溶液中滴加硫酸铜溶液 | 产生气体的速率加快 | 硫酸铜作该反应的催化剂 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、浓氨水易挥发,遇到易挥发性的浓盐酸或浓硝酸,会形成白烟;
B、二氧化硫通入硝酸钡溶液中形成稀硝酸溶液会氧化二氧化硫为硫酸,硫酸根离子结合钡离子形成沉淀;
C、锌和加入的硫酸铜反应,铜附着在锌表面在稀硫酸溶液中形成原电池反应;
D、火焰呈黄色隔着钴玻璃呈紫色为钾元素;
解答 解:A、浓氨水易挥发,遇到易挥发性的浓盐酸或浓硝酸,会形成白烟,实验操作、现象和结论均正确,故A正确;
B、二氧化硫通入硝酸钡溶液中形成稀硝酸溶液会氧化二氧化硫为硫酸,硫酸根离子结合钡离子形成沉淀,不是SO2与可溶性钡盐均可生成白色沉淀,故B错误;
C、锌和加入的硫酸铜反应,铜附着在锌表面在稀硫酸溶液中形成原电池反应,加快反应速率,硫酸铜作不是该反应的催化剂,故C错误;
D、火焰呈黄色隔着钴玻璃呈紫色为钾元素,该溶液不一定是钠盐溶液,故D错误;
故选A.
点评 本题考查了二氧化硫性质的分析判断,主要是性质的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
8.下列各项中“操作或现象”能达到预期“实验目的”的是( )
| 选项 | 目 的 | 操作或现象 |
| A | 制备无水FeCl3 | 将FeCl3溶液加热蒸干 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 证明非金属性Cl>C>Si | 向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D | 测定NaCl中混有Na2CO3的量 | 取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |
| A. | A | B. | B | C. | C | D. | D |
15.焦炭可用于制备电石、生产水煤气等.
完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是离子晶体;其与水反应的化学方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(2)制备电石还需要用到CaCO3.组成CaCO3的三种元素原子半径按从大到小的顺序排列为Ca>C>O.氧原子的核外电子排布式为1s22s22p4.
(3)与同主族元素Mg相比,Ca的金属性更强(填“强”或者“弱”),能证明这一结论的实验事实是金属钙与水的反应比金属镁剧烈[Ca(OH)2是强碱,Mg(OH)2是弱碱].
用焦炭生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g).
完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是d.(选填编号)
a.容器中的压强不再改变
b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2L的恒容密闭容器中,进行反应,得到如下数据:
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为8×10-4mol/(L•min).
②下列图象正确的是bc.(选填编号)

完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是离子晶体;其与水反应的化学方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(2)制备电石还需要用到CaCO3.组成CaCO3的三种元素原子半径按从大到小的顺序排列为Ca>C>O.氧原子的核外电子排布式为1s22s22p4.
(3)与同主族元素Mg相比,Ca的金属性更强(填“强”或者“弱”),能证明这一结论的实验事实是金属钙与水的反应比金属镁剧烈[Ca(OH)2是强碱,Mg(OH)2是弱碱].
用焦炭生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g).
完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是d.(选填编号)
a.容器中的压强不再改变
b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2L的恒容密闭容器中,进行反应,得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | C | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
②下列图象正确的是bc.(选填编号)

5.回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
请回答下列问题:
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
12.已知平衡:
①C2H4(g)?C2H2(g)+H2(g),
②2CH4(g)?C2H4(g)+2H2(g).当升高温度时,①和②式皆向右移动.
(1)C(s)+2H2(g)?CH4(g)△H1
(2)2C(s)+H2(g)?C2H2(g)△H2
(3)2C(s)+2H2(g)?C2H4(g)△H3
下列有关(1)、(2)和(3)中的△H1、△H2、△H3大小顺序排列正确的是( )
①C2H4(g)?C2H2(g)+H2(g),
②2CH4(g)?C2H4(g)+2H2(g).当升高温度时,①和②式皆向右移动.
(1)C(s)+2H2(g)?CH4(g)△H1
(2)2C(s)+H2(g)?C2H2(g)△H2
(3)2C(s)+2H2(g)?C2H4(g)△H3
下列有关(1)、(2)和(3)中的△H1、△H2、△H3大小顺序排列正确的是( )
| A. | △H1>△H2>△H3 | B. | △H2>△H3>2△H1 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△H1 |
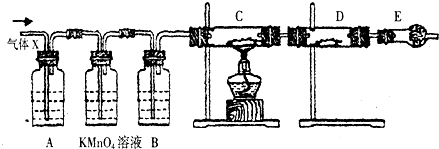
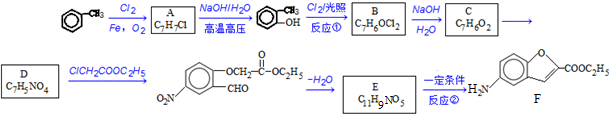
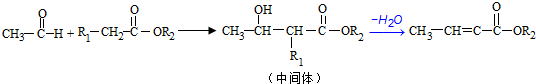
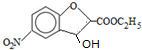 ;反应①的反应类型为取代反应;
;反应①的反应类型为取代反应;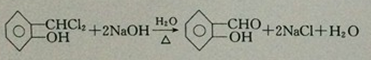 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为
;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为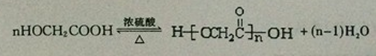 ;
;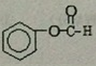 .
.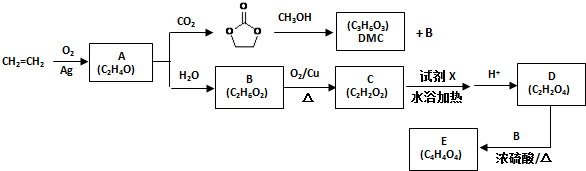
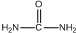 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式