题目内容
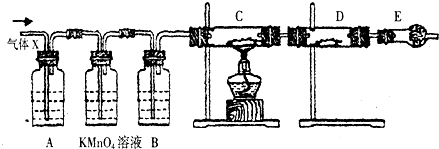
5. 在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.(1)下列实验不合理的是:D
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证S02的生成
C.③中选用NaOH溶液吸收多余的S02
D.为确认CuS04生成,向①中加水,观察颜色
(2)装置①和③发生的反应的化学方程式分别是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;SO2+2NaOH═Na2SO3+H2O
(3)如果将装置中的②换成石蕊试液,则现象是溶液变红.
(4)如果将装置中的②换成酸性高锰酸钾溶液,则反应的离子方程式为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+.
(5)直接排放含SO2的烟气会形成酸雨,危害环境.用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4.
分析 (1)A.在加热的条件下,当铜丝与浓硫酸接触时才能反应;
B.品红能被二氧化硫漂白,根据SO2的漂白性分析;
C.SO2为酸性氧化物,可与碱发生反应;
D.试管①中含有浓硫酸,加入水后会发生暴沸现象,应该将反应后的溶液加入盛有水的烧杯中;
(2)装置①中铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水;试管③中氢氧化钠与二氧化硫反应生成亚硫酸钠和水,据此写出反应的化学方程式;
(3)二氧化硫为酸性氧化物,其水溶液显示酸性,所以换成酸性高锰酸钾溶液后溶液会变红;
(4)酸性高锰酸钾溶液具有强氧化性,能够将二氧化硫氧化成硫酸根离子,据此写出反应的离子方程式;
(5)二氧化硫与水反应生成亚硫酸、亚硫酸与空气中氧气反应生成硫酸,从而导致雨水显示酸性.
解答 解:(1)A.在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;
B.SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故B正确;
C.SO2为酸性气体,具有污染性,可与碱发生反应,生成亚硫酸钠和水,可用NaOH溶液吸收多余的SO2,故C正确;
D.反应后的试管①中含有浓硫酸,向试管中加入水后会发生暴沸现象,导致混合液溅出,若观察溶液颜色,应该将混合液加入烧杯中,故D错误;
故答案为:D;
(2)试管①中铜与浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;试管③中二氧化硫与氢氧化钠溶液反应生成亚硫酸钠、水,反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O,
故答案为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;SO2+2NaOH═Na2SO3+H2O;
(3)二氧化硫溶液显示酸性,如果将装置中的②换成石蕊试液,则溶液会变成红色,故答案为:溶液变红;
(4)如果将装置中的②换成酸性高锰酸钾溶液,二氧化硫被氧化成硫酸根离子,反应的离子方程式为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,
故答案为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
(5)直接排放含SO2的烟气会形成酸雨,危害环境,用化学方程式表示SO2形成硫酸型酸雨的反应为:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4,
故答案为:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4.
点评 本题考查了浓硫酸的化学性质、酸雨的形成过程等知识,题目难度中等,注意掌握铜与浓硫酸的反应原理,明确二氧化硫的化学性质及检验方法,试题侧重考查学生的分析能力及化学实验能力.

| t/min | 2 | 4 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率x(Z)=2.0×10-3mol•L-1min-1 | |
| B. | 其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少 | |
| C. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| D. | 保持其他条件不变,起始时向溶液中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol |
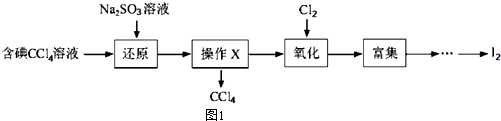
完成下列填空
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+该操作将I2还原为I的目的是将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液
(2)操作X的名称为分液,所用的主要仪器是分液漏斗
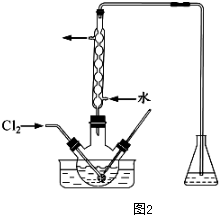
(3)氧化时,在三颈瓶中将含“I”的水溶液用盐酸调至pH约为2,华安满通入Cl2,在40℃左右反应(实验装置如图2所示),实验控制在较低温度下进行原因是防止碘升华或者被氧化、增大氯气溶解度锥形瓶中的溶液为NaOH溶液
(4)浓海水提取镁的工艺流程如图3所示
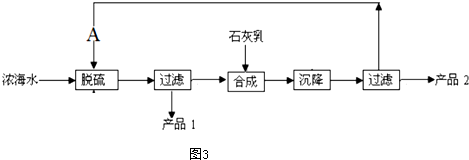
浓海水的主要成分如下
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g.l-2) | 63.7 | 28.8 | 144.6 | 46.4 |
1L浓海水最多可得到产品2的质量为69.6g.
完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是离子晶体;其与水反应的化学方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(2)制备电石还需要用到CaCO3.组成CaCO3的三种元素原子半径按从大到小的顺序排列为Ca>C>O.氧原子的核外电子排布式为1s22s22p4.
(3)与同主族元素Mg相比,Ca的金属性更强(填“强”或者“弱”),能证明这一结论的实验事实是金属钙与水的反应比金属镁剧烈[Ca(OH)2是强碱,Mg(OH)2是弱碱].
用焦炭生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g).
完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是d.(选填编号)
a.容器中的压强不再改变
b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2L的恒容密闭容器中,进行反应,得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | C | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
②下列图象正确的是bc.(选填编号)