题目内容
6.0.1mol•L-1的Na2S溶液中,下面说法正确的是( )| A. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | B. | c(Na+)=2c(HS-)+2c(S2-)+c(H2S) | ||
| C. | c(Na+)>c(OH-)>c(HS-)>c(H+) | D. | c(H2S)+c(HS-)+c(H+)=c(OH-) |
分析 A、根据电荷守恒,分析解答;
B、根据物料守恒,分析解答;
C、溶液中硫离子水解但程度较小,硫离子两步水解都生成OH-,硫离子只有一步水解生成HS-,由此分析;
D、根据质子守恒分析解答.
解答 解:A、根据电荷守恒,可知c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故A错误;
B、根据物料守恒,可知:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S),故B错误;
C、溶液中硫离子水解但程度较小,硫离子两步水解都生成OH-,硫离子只有一步水解生成HS-,所以c (HS-)<c (OH-),故C正确;
D、溶液中存在电荷守恒c(Na+)+c (H+)=2c (S2-)+c (HS-)+c (OH-),存在物料守恒c(Na+)=2c(S2-)+2c (HS-)+2c (H2S),所以c(OH-)=c(H+)+c(HS-)+2c(H2S),故D错误;
故选:C.
点评 本题考查了离子浓度大小比较,离子浓度大小比较常常涉及盐类水解、弱电解质的电离,易错选项是C,注意守恒思想的运用,题目难度中等.

练习册系列答案
相关题目
17.在一定温度下,将气体X和气体Y各0.16mol充入10.1,恒容器闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率x(Z)=2.0×10-3mol•L-1min-1 | |
| B. | 其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少 | |
| C. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| D. | 保持其他条件不变,起始时向溶液中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol |
14.海水是一种丰富的资源,工业生产可以从海水中提取许多有用的物质,这些物质广泛应用于生活、生产、科技等砝码,如图1是含碘CCl4溶液得到碘的实验过程.
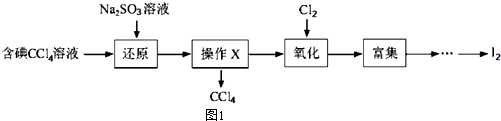
完成下列填空
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+该操作将I2还原为I的目的是将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液
(2)操作X的名称为分液,所用的主要仪器是分液漏斗
(3)氧化时,在三颈瓶中将含“I”的水溶液用盐酸调至pH约为2,华安满通入Cl2,在40℃左右反应(实验装置如图2所示),实验控制在较低温度下进行原因是防止碘升华或者被氧化、增大氯气溶解度锥形瓶中的溶液为NaOH溶液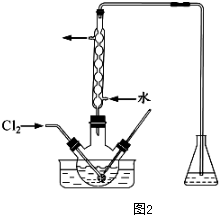
(4)浓海水提取镁的工艺流程如图3所示
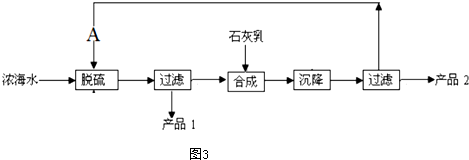
浓海水的主要成分如下
该工艺过程中,脱碱阶段主要反应的离子方程式为Ca2++SO42-=CaSO4↓产品2的化学式为Mg(OH)2
1L浓海水最多可得到产品2的质量为69.6g.

完成下列填空
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+该操作将I2还原为I的目的是将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液
(2)操作X的名称为分液,所用的主要仪器是分液漏斗
(3)氧化时,在三颈瓶中将含“I”的水溶液用盐酸调至pH约为2,华安满通入Cl2,在40℃左右反应(实验装置如图2所示),实验控制在较低温度下进行原因是防止碘升华或者被氧化、增大氯气溶解度锥形瓶中的溶液为NaOH溶液

(4)浓海水提取镁的工艺流程如图3所示

浓海水的主要成分如下
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g.l-2) | 63.7 | 28.8 | 144.6 | 46.4 |
1L浓海水最多可得到产品2的质量为69.6g.
1.现有物质的量浓度均为0.1mol/L的溶液①NH3•H2O②CH3COOH③KHSO4.下列有关离子浓度分析一定不正确的是( )
| A. | 向①中逐滴加入少量②,$\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$逐渐增大 | |
| B. | ①、③等体积混合后溶液中存在:NH4++H2O?NH3•H2O+H+ | |
| C. | ①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+) | |
| D. | ①、③按体积比2:1混合:c(NH4+)>c(NH3•H2O)>c(SO42-)>c(OH-)>c(H+) |
15.焦炭可用于制备电石、生产水煤气等.
完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是离子晶体;其与水反应的化学方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(2)制备电石还需要用到CaCO3.组成CaCO3的三种元素原子半径按从大到小的顺序排列为Ca>C>O.氧原子的核外电子排布式为1s22s22p4.
(3)与同主族元素Mg相比,Ca的金属性更强(填“强”或者“弱”),能证明这一结论的实验事实是金属钙与水的反应比金属镁剧烈[Ca(OH)2是强碱,Mg(OH)2是弱碱].
用焦炭生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g).
完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是d.(选填编号)
a.容器中的压强不再改变
b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2L的恒容密闭容器中,进行反应,得到如下数据:
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为8×10-4mol/(L•min).
②下列图象正确的是bc.(选填编号)

完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是离子晶体;其与水反应的化学方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(2)制备电石还需要用到CaCO3.组成CaCO3的三种元素原子半径按从大到小的顺序排列为Ca>C>O.氧原子的核外电子排布式为1s22s22p4.
(3)与同主族元素Mg相比,Ca的金属性更强(填“强”或者“弱”),能证明这一结论的实验事实是金属钙与水的反应比金属镁剧烈[Ca(OH)2是强碱,Mg(OH)2是弱碱].
用焦炭生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g).
完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是d.(选填编号)
a.容器中的压强不再改变
b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2L的恒容密闭容器中,进行反应,得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | C | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
②下列图象正确的是bc.(选填编号)

16.(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5-8.6之间.某地海水中主要离子的含量如表:
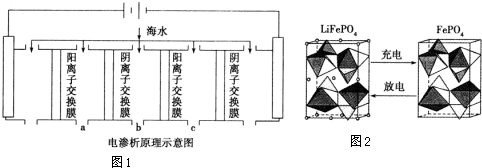
电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(2)锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(3)目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
①用K2FeO4处理中性废水时,K2FeO4与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的聚沉 作用.
②MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:MFe2Ox$→_{SO_{2}}^{常温下}$MFe2Oy 则可以判断x<y,氧化性:MFe2Oy< SO2(填“>”、“<”或“=”)
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(2)锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(3)目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
①用K2FeO4处理中性废水时,K2FeO4与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的聚沉 作用.
②MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:MFe2Ox$→_{SO_{2}}^{常温下}$MFe2Oy 则可以判断x<y,氧化性:MFe2Oy< SO2(填“>”、“<”或“=”)
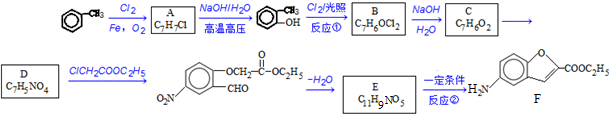
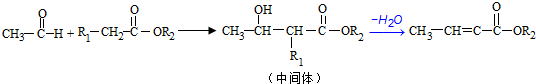
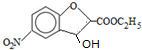 ;反应①的反应类型为取代反应;
;反应①的反应类型为取代反应;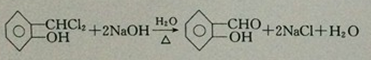 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为
;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为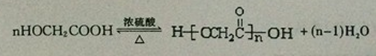 ;
;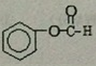 .
.