题目内容
16.亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:①2NO+Na2O2=2NaNO2②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+.
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目
 .
.(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO).
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2.
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625.
(结果保留4位有效数字)
分析 (1)碳与浓硝酸在加热条件下反应生成二氧化碳、二氧化氮和水,据此写出方程式,根据化合价变化标出电子转移的方向和数目;
(2)装置C中需要用NO和过氧化钠反应,则装置B是用于提供NO气体;
(3)通过B装置的气体中含有二氧化碳、NO和水,需要将二氧化碳和水除去,据此选用试剂,并画出装置图;
(4)酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+,据此设计实验方案检验装置C中NaNO2的存在;
(5)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,
A.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,标准液浓度减小;
B.达到过程中锥形瓶不需要干燥,不影响待测液中溶质的物质的量;
C.滴定终了仰视读数,读出的是凹液面下方读数,读数比实际消耗的标准液体积偏大;
D.滴定终了俯视读数,读出的是凹液面上方读数,读数比实际读数偏小;
(6)第一组数据舍弃,计算出其它3组消耗标准液的平均体积,再结合反应方程式计算出样品中亚硝酸钠的质量及质量分数.
解答 解:(1)装置A中C与浓硝酸反应的化学方程式的方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,反应中电子转移数目为4,标出电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(2)根据实验装置可知,装置C中发生反应:2NO+Na2O2=2NaNO2,则装置B的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO),
故答案为:将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO);
(3)为制备纯净NaNO2,需要将进入装置C的气体中的二氧化碳和水除去,碱石灰能够吸收二氧化碳和水,故可以选用碱石灰,装置图如: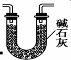 或
或 ,
,
故答案为: 或
或 ;
;
(4)根据题中信息可知,酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+,据此可设计出检验亚硝酸钠的方法为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2,
故答案为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;
(5)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,会导致测量结果偏高,
A.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,滴定过程中消耗的标准液体积会偏大,故A正确;
B.锥形瓶不需要干燥,所以锥形瓶洗净后未干燥,不影响测定结果,故B错误;
C.滴定终了仰视读数,导致读数偏大,计算出的标准液体积偏大,故C正确;
D.滴定终了俯视读数,滴定管读数偏小,计算出的标准液体积偏小,故D错误;
故答案为:AC;
(6)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:$\frac{20.02+20.00+19.98}{3}$mL=20.00mL,
25mL样品消耗高锰酸钾的物质的量为:0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为:0.002mol×$\frac{250mL}{25mL}$=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为:0.02mol×$\frac{5}{2}$=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:$\frac{3.45g}{4.000g}$×100%=86.25%,
故答案为:86.25%或0.8625.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度较大,涉及性质实验方案的设计、中和滴定操作及误差分析、氧化还原反应中电子转移的分析、化学计算等知识,明确实验原理及化学实验基本操作方法为解答关键,试题培养了学生的分析、理解能力及化学实验、化学计算能力.

| A. | 1L 0.5mol•L-1 NH4NO3溶液中含氮原子数目6.02×1023 | |
| B. | 标准状况下,22.4L C3H8含有C-H键的数目为6.02×1023 | |
| C. | 32g SO2与足量O2混合充分反应,转移的电子数目为6.02×1023 | |
| D. | 常温下,500mL pH=0的硫酸溶液中含有的H+数目为6.02×1023 |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
| 操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解. 操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中. 操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处. |
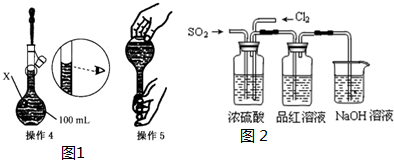
①仪器X的名称是100mL容量瓶.
②关于该配制过程,下列说法正确的是AB.
A.操作1中,应称取胆矾晶体的质量为2.5g
B.操作2中,洗涤液需要转移到仪器X中
C.操作4称为定容,由于该同学观察方法不正确,将导致所配溶液浓度偏高
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)甲、乙同学用下图装置验证SO2和Cl2的漂白性:甲同学按1:1通气时,品红溶液几乎不褪色,品红溶液不褪色的原因是(用方程式表示):SO2+Cl2+2H2O=SO42-+2Cl-+4H+;而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,乙同学做到让品红溶液变得越来越浅的原因是增加二氧化硫的通入量或增加氯气通入量.
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数X>Y | D. | 质子数Y>X |
| A. | NaOH溶液 | B. | Na2CO3溶液 | C. | NaHSO3溶液 | D. | KI溶液 |
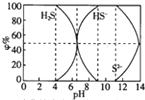 25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布如图如下,下列结论正确的是( )
25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布如图如下,下列结论正确的是( )| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/LCuSO4都有CuS沉淀(Ksp(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
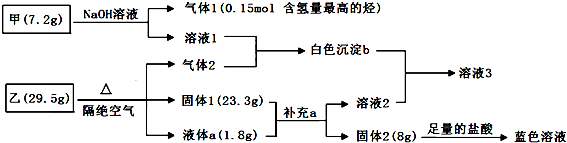
 .
. 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.