��Ŀ����
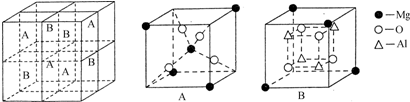
5��ij�о�С��Ϊ��̽������ף���Ԫ����������ң��������Σ�������Ԫ�أ�����ɺ����ʣ���Ʋ����������ʵ�飺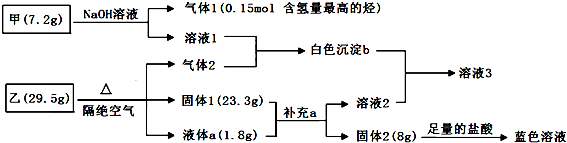
��֪������Һ1�������μ����ᣬ�Ȳ�����ɫ������������ܽ⣻����2����ɫ��ζ���壬����Һ2������ͨ������2��Ҳ���Ȳ�����ɫ������������ܽ⣮��ش��������⣺
��1���Ļ�ѧʽAl4C3������1�ĵ���ʽ
 ��
����2�����������£�����1�����2��Ӧ���ɲ�������һ�������һ�ֹ��壬�÷�Ӧ�Ļ�ѧ����ʽΪ4CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$4Cu+CO2+2H2O��8CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$4Cu2O+CO2+2H2O��3CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$3Cu+CO+2H2O��6CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$3Cu2O+CO+2H2O��
��3���ҵĻ�ѧʽBaCO3•Cu��OH��2��BaCu��OH��2CO3��
��4����������2����Һ1��Ӧ�����ӷ���ʽΪCO2+AlO2-+2H2O=Al��OH��3��+HCO3-��������Ϊ���жϸ÷�Ӧ������2�Ƿ�������ѣ�Ӧ������һ�ֲ����ǡ����Ρ����ǡ���ʽ�Ρ����м��飬�����ʵ��֤����һ����ijɷ�ȡ��Ӧ�����Һ�������Թ��У��μӹ�����CaCl2��Һ�������ְ�ɫ������������������Σ����˺�����Һ�еμ�NaOH��Һ�����ֳ��ְ�ɫ�����������������ʽ�Σ������߶����֣�Ϊ����������ѡ���Լ�Ϊ����ˮ��NaOH��Һ��ϡ���ᡢCaCl2��Һ��
���� ��NaOH��Һ��Ӧ��������1������1�Ǻ�������ߵ�����ΪCH4������Ԫ���غ�֪���к���CԪ�أ���������ʵ���Ϊ0.15mol������Cԭ���غ��m��C��=0.15mol��12g/mol=1.8g�����Ƕ�Ԫ�������һ��Ԫ������Ϊ7.2g-1.8g=5.4g������Һ1�������μ����ᣬ�Ȳ�����ɫ������������ܽ⣬����Һ1Ϊƫ�����Σ�����Ԫ���غ�֪����Һ1ΪNaAlO2����n��Al��=$\frac{5.4g}{27g/mol}$=0.2mol��C��Alԭ�Ӹ���֮��=0.15mol��0.2mol=3��4�����ΪAl4C3��
ƫ�����ƺ�����2��Ӧ���ɰ�ɫ����bΪAl��OH��3������2Ϊ�������壻
����2��ϡ���ᷴӦ������ɫ��Һ������2�к���CuԪ�أ�����1����Һa��ϵõ���Һ2����2����Һ2���ܽ���������������Һ2������ͨ������2���Ȳ�����ɫ������������ܽ⣬����Һ2Ϊǿ����Һ����Һ2ֻ����Ba��OH��2������1��Һ��a��ϵõ���Һ2����aΪH2O���ҹ���1�к���BaO������1Ϊ��������Ի�����CuO��
���������غ������2����=29.5g-1.8g-23.3g=4.4g��������2Ϊ��ɫ��ζ���壬������������Һ��ͨ������2�������ɰ�ɫ�������ɫ�����ܽ⣬������2ΪCO2��n��CO2��=$\frac{4.4g}{44g/mol}$=0.1mol��n��CuO��=$\frac{8g}{80g/mol}$=0.1mol��n��BaO��=$\frac{23.3g-8g}{153g/mol}$=0.1mol��n��H2O��=$\frac{1.8g}{18g/mol}$=0.1mol��
����Ba��Cu��H��O��Cԭ�Ӹ���֮��=n��BaO����n��CuO����2n��H2O����[2n��CO2��+n��BaO��+n��CuO��+n��H2O��]��n��CO2��=0.1mol��0.1mol��0.2mol��0.5mol��0.1mol=1��1��2��5��1���仯ѧʽΪBaCO3•Cu��OH��2��BaCu��OH��2CO3���ݴ˷������
��� �⣺��NaOH��Һ��Ӧ��������1������1�Ǻ�������ߵ�����ΪCH4������Ԫ���غ�֪���к���CԪ�أ���������ʵ���Ϊ0.15mol������Cԭ���غ��m��C��=0.15mol��12g/mol=1.8g�����Ƕ�Ԫ�������һ��Ԫ������Ϊ7.2g-1.8g=5.4g������Һ1�������μ����ᣬ�Ȳ�����ɫ������������ܽ⣬����Һ1Ϊƫ�����Σ�����Ԫ���غ�֪����Һ1ΪNaAlO2����n��Al��=$\frac{5.4g}{27g/mol}$=0.2mol��C��Alԭ�Ӹ���֮��=0.15mol��0.2mol=3��4�����ΪAl4C3��
ƫ�����ƺ�����2��Ӧ���ɰ�ɫ����bΪAl��OH��3������2Ϊ�������壻
����2��ϡ���ᷴӦ������ɫ��Һ������2�к���CuԪ�أ�����1����Һa��ϵõ���Һ2����2����Һ2���ܽ���������������Һ2������ͨ������2���Ȳ�����ɫ������������ܽ⣬����Һ2Ϊǿ����Һ����Һ2ֻ����Ba��OH��2������1��Һ��a��ϵõ���Һ2����aΪH2O���ҹ���1�к���BaO������1Ϊ��������Ի�����CuO��
���������غ������2����=29.5g-1.8g-23.3g=4.4g��������2Ϊ��ɫ��ζ���壬������������Һ��ͨ������2�������ɰ�ɫ�������ɫ�����ܽ⣬������2ΪCO2��n��CO2��=$\frac{4.4g}{44g/mol}$=0.1mol��n��CuO��=$\frac{8g}{80g/mol}$=0.1mol��n��BaO��=$\frac{23.3g-8g}{153g/mol}$=0.1mol��n��H2O��=$\frac{1.8g}{18g/mol}$=0.1mol��
����Ba��Cu��H��O��Cԭ�Ӹ���֮��=n��BaO����n��CuO����2n��H2O����[2n��CO2��+n��BaO��+n��CuO��+n��H2O��]��n��CO2��=0.1mol��0.1mol��0.2mol��0.5mol��0.1mol=1��1��2��5��1���仯ѧʽΪBaCO3•Cu��OH��2��BaCu��OH��2CO3��
��1��ͨ�����Ϸ���֪����ΪAl4C3������1�Ǽ��飬����ʽΪ ���ʴ�Ϊ��Al4C3��
���ʴ�Ϊ��Al4C3�� ��
��
��2������1�Ǽ��顢����2��CuO�����������£�����1�����2��Ӧ���ɲ�������һ�������һ�ֹ��壬���ɵ�����Ӧ���Ƕ�����̼��CO��������Cu��Cu2O������Ԫ���غ�֪��Ӧ������ˮ�����Ը÷�Ӧ�Ļ�ѧ����ʽΪ4CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$4Cu+CO2+2H2O��8CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$4Cu2O+CO2+2H2O��3CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$3Cu+CO+2H2O��6CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$3Cu2O+CO+2H2O��
�ʴ�Ϊ��4CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$4Cu+CO2+2H2O��8CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$4Cu2O+CO2+2H2O��3CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$3Cu+CO+2H2O��6CuO+CH4$\frac{\underline{\;\;��\;\;}}{\;}$3Cu2O+CO+2H2O��
��3��ͨ�����Ϸ���֪����ΪBaCO3•Cu��OH��2��BaCu��OH��2CO3���ʴ�Ϊ��BaCO3•Cu��OH��2��BaCu��OH��2CO3��
��4������2�Ƕ�����̼����Һ1Ϊƫ�����ƣ�����������̼��ƫ�����Ʒ�Ӧ��������������̼�����ƣ����ӷ���ʽΪCO2+AlO2-+2H2O=Al��OH��3��+HCO3-��̼������Ӻͱ����ӷ�Ӧ����̼�ᱵ������̼��������Ӻͱ����Ӳ���Ӧ����������鷽���ǣ�ȡ��Ӧ�����Һ�������Թ��У��μӹ�����CaCl2��Һ�������ְ�ɫ������������������Σ����˺�����Һ�еμ�NaOH��Һ�����ֳ��ְ�ɫ�����������������ʽ�Σ������߶����֣�Ϊ������
�ʴ�Ϊ��CO2+AlO2-+2H2O=Al��OH��3��+HCO3-��ȡ��Ӧ�����Һ�������Թ��У��μӹ�����CaCl2��Һ�������ְ�ɫ������������������Σ����˺�����Һ�еμ�NaOH��Һ�����ֳ��ְ�ɫ�����������������ʽ�Σ������߶����֣�Ϊ������
���� ���⿼�������ƶϣ��漰����Cu��BaԪ�ؼ��仯����֪ʶ����ȷƫ�����������ǽⱾ��ؼ������ԭ���غ�ȷ�����ʻ�ѧʽ����Ŀ�Ѷ��еȣ�

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д�| A�� | ���ᱡ�ɴ�����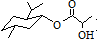 ��ֻ�ܷ���ˮ�⡢��������ȥ��Ӧ ��ֻ�ܷ���ˮ�⡢��������ȥ��Ӧ | |
| B�� | ��ȩ�ͱ�ϩȩ����ͬϵ����ǵ��⻯����Ҳһ������ͬϵ�� | |
| C�� | ����ʽΪC7H14O2���л����У���3�������ܷ���������Ӧ���ܷ���ˮ�ⷴӦ��ͬ���칹����Ŀ��8�� | |
| D�� | �������͡�������ά��Ӳ֬���������������Ϊͬ���칹�壬��ˮ�����Ҳ��ȫ����ͬ |
| A�� | ${\;}_{17}^{35}$Cl2��${\;}_{17}^{37}$Cl2�����������������Ϊͬλ�� | |
| B�� | ${\;}_{34}^{78}$Se��${\;}_{34}^{80}$Se������������ͬ����������ͬ | |
| C�� | ͬ����Ԫ���γɵĺ������������˵���������Ӷ����� | |
| D�� | ͬ��������Ԫ���γɵļ����Ӱ뾶��˵�������������С |
| A�� | ʵ����Ҫ����500mL 0.2mol•L-1 KCl��Һ������������ƽ����7.45gKCl���� | |
| B�� | ʵ������������Ϊ�˼ӿ췴Ӧ���ʣ�����ϡH2SO4�еμ�����Cu��NO3��2��Һ | |
| C�� | �ų���ʽ�ζ��ܼ��������ʱ����������������Ƥ�ܣ�Ȼ��ѹ�������ų����� | |
| D�� | ������FeBr2��FeI2�Ļ����Һ��ͨ��������������Ȼ�����Һ���ɡ����գ��õ�FeCl3���� |
| A�� | ��ʳ����ϴ��ˮ����ˮ�� | |
| B�� | �����Ρ���������ˮ�� | |
| C�� | ����Ƿ۴���ɢ���ڵ��ϵĹ� | |
| D�� | �ö������������ʳ��ˮ�͵�����Һ |
| A�� | ������������ʯˮ�ࡢ�ͻ�ש�Ƚ������� | |
| B�� | ú��ʯ�еĽ����������Ϊ���������� | |
| C�� | P2O5��SO3��Ӧˮ��������Խ�ǿ���� H3PO4 | |
| D�� | �����ػ��ã��ܵ��GaCl3ˮ��Һ�Ʊ��ص��� |
| A�� | �����ǵ�������Ӧ����Ũ������������̿�����ڣ�C6H12O6�������ǣ�$\stackrel{Ũ����}{��}$ 6C+6H2O | |
| B�� | ��AgNO3��Һ�м������Na2S��Һ���ټ���NaCl��Һ����ɫ������ɰ�ɫ��Ag2S+2Cl-=2AgCl��+S2- | |
| C�� | ��NH3ͨ����з�̪��ˮ�У���Һ��죺NH3+H2O?NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| D�� | ������ˮ��ҺpH��7��Al3++3H2O?Al��OH��3�����壩+3H+ |
��2NO+Na2O2=2NaNO2��2NO2+Na2O2=2NaNO3
������KMnO4��Һ�ɽ�NO2-����ΪNO3-��MnO4-��ԭ��Mn2+��
��Ʒ�Ʊ�����飺����ͼ1װ���Ʊ�NaNO2��

��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ
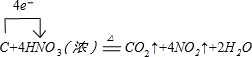 ��
����2��Bװ�õ������ǽ�NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO����
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ�����̼���ƺ��������ƣ�Ϊ�Ʊ�����NaNO2Ӧ��B��Cװ�ü�����һ��װ�ã������ҿ��ڻ������ӵ�װ��ͼ2��������ʢ�ŵ��Լ���
��4�������ʵ�����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬������ϡ�����ữ���μ���1-2�Σ�����������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2��
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.000g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
| ����� | 1 | 2 | 3 | 4 |
| KMnO4��Һ���/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ��������Ӷ���
D���ζ����˸��Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������86.25%��0.8625��
���������4λ��Ч���֣�