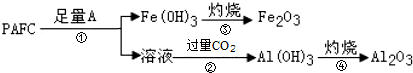
题目内容
6.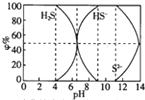 25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布如图如下,下列结论正确的是( )
25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布如图如下,下列结论正确的是( )| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/LCuSO4都有CuS沉淀(Ksp(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
分析 A、当c(HS-)>c(S2-)时,图象分析可知溶液中只存在NaHS、Na2S,12>pH>6.5时,c(HS-)>c(S2-),溶液可以显酸性或碱性;
B、当pH=7时溶液呈中性,c(H+)=c(OH-),硫元素存在微粒为HS-和H2S,依据溶液中电荷守恒:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-)计算;
C、12>pH>4,溶液中存在微粒HS-,H2S,滴加0.1mol/L CuSO4溶液,依据图象和Ksp分析可知两种情况下都生成沉淀;
D、当pH=9时,溶液全部是NaHS,依据溶液中质子守恒和电荷守恒计算分析.
解答 解:A、当c(HS-)>c(S2-)时,图象分析可知溶液中只存在NaHS、Na2S,S2-+H2O?HS-+OH-,12>PH>6.5时,c(HS-)>c(S2-),溶液可以显酸性或碱性,故A错误;
B、当pH=7时溶液呈中性,c(H+)=c(OH-),硫元素存在微粒为HS-和H2S,依据溶液中电荷守恒:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-),计算得到c(Na+)=c(HS-)+2c(S2-),故B错误;
C、12>PH>4,溶液中存在微粒HS-,H2S,滴加0.1mol/L CuSO4溶液,设溶液体积1L,HS-为x,H2S浓度0.1-x,HS-+Cu2+=CuS↓+2H+,H2S+Cu2+=CuS↓+2H+,x<0.1mol/L,铜离子过量,溶液中过量的铜离子浓度为c(Cu2+)=(0.1-x)mol/L,依据Ksp计算溶液中c(S2-)=$\frac{6.3×1{0}^{-36}}{0.1-x}$<10-5mol/L,所以溶液硫离子全部沉淀,溶液中一定生成硫化铜沉淀,故C正确;
D、当pH=9时,溶液全部是NaHS,依据溶液中质子守恒得到:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-),物料守恒为:c(Na+)=c(HS-)+2c(S2-)+c(H2S),则c(H+)+c(HS-)=c(OH-)+c(HS-),故D错误;
故选C.
点评 本题考查了图象分析判断,电解质溶液中离子浓度大小分析应用,物料守恒、电荷守恒、计算分析判断,注意图象的理解应用,掌握基础是关键,题目难度较大.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案①2NO+Na2O2=2NaNO2②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+.
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目
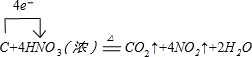 .
.(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO).
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2.
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625.
(结果保留4位有效数字)
| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |
| A. | NH4Br的电子式: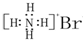 | |
| B. | S的结构示意图: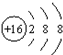 | |
| C. | 次氯酸的结构式:H-Cl-O | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
| A. | 与氢气反应的难易程度 | B. | 氢化物的熔沸点 | ||
| C. | 非金属性的强弱 | D. | 氢化物稳定性 |
 >H2CO3>
>H2CO3> >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 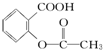 转变为
转变为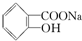 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与足量的NaOH溶液共热后,再加入适量H2SO4 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 |
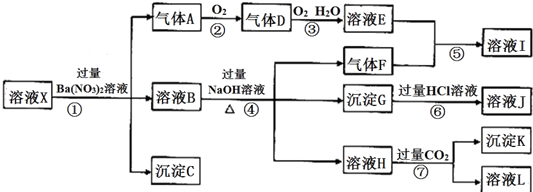
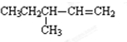
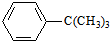 .
.