题目内容
1.(1)某同学欲配制98.0mL0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:| 操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解. 操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中. 操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处. |

①仪器X的名称是100mL容量瓶.
②关于该配制过程,下列说法正确的是AB.
A.操作1中,应称取胆矾晶体的质量为2.5g
B.操作2中,洗涤液需要转移到仪器X中
C.操作4称为定容,由于该同学观察方法不正确,将导致所配溶液浓度偏高
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)甲、乙同学用下图装置验证SO2和Cl2的漂白性:甲同学按1:1通气时,品红溶液几乎不褪色,品红溶液不褪色的原因是(用方程式表示):SO2+Cl2+2H2O=SO42-+2Cl-+4H+;而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,乙同学做到让品红溶液变得越来越浅的原因是增加二氧化硫的通入量或增加氯气通入量.
分析 (1)①依据仪器的图形及用途说出其名称;
②A.依据m=CVM计算需要溶质的质量;
B.为保证溶质全部转移到容量瓶,洗涤液应移入容量瓶;
C.定容时,仰视刻度线,导致溶液的体积偏大;
D.摇匀后静置,发现液面低于刻度线,属于正常现象,再加水则溶液的体积偏大;
(2)次氯酸具有漂白性,二氧化硫具有漂白性,氯气与二氧化硫按照1:1反应生成硫酸和盐酸失去漂白作用.
解答 解:(1)①图中仪器x为100mL容量瓶,故答案为:100mL容量瓶;
②依据m=CVM=0.10mol•L-1×0.1L×250g/mol=2.5g,故A正确;
B.为保证溶质全部转移到容量瓶,洗涤液应移入容量瓶,故B正确;
C.定容时,仰视刻度线,导致溶液的体积偏大,溶液浓度偏小,故C错误;
D.摇匀后静置,发现液面低于刻度线,属于正常现象,再加水则溶液的体积偏大,导致溶液浓度偏小,故D错误;
故选:AB;
(2)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,离子方程式:SO2+Cl2+2H2O=SO42-+2Cl-+4H+;
如果SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性,所以为使品红褪色,通入的二氧化硫与氯气的物质的量不相等,
故答案为:SO2+Cl2+2H2O=SO42-+2Cl-+4H+;二氧化硫;氯气.
点评 本题考查了一定物质的量浓度溶液的配制,氯气、二氧化硫的性质,熟悉配制原理及物质的性质是解题关键,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
10.下列应用涉及氧化还原反应的是( )
| A. | 用食醋清洗烧水壶的水垢 | |
| B. | 用铝盐、铁盐作净水剂 | |
| C. | 用硫磺粉处理散落在地上的汞 | |
| D. | 用丁达尔现象区分食盐水和淀粉溶液 |
16.亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO+Na2O2=2NaNO2②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+.
Ⅰ.产品制备与检验:用如图1装置制备NaNO2: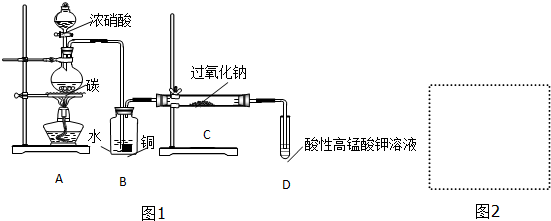
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目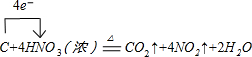 .
.
(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO).
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2.
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
(5)第一组实验数据出现异常,造成这种异常的原因可能是AC(双项选择).
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625.
(结果保留4位有效数字)
①2NO+Na2O2=2NaNO2②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+.
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目
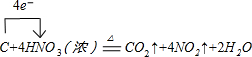 .
.(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO).
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2.
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625.
(结果保留4位有效数字)
6.下面是同周期元素原子的价电子排布式,第一电离能最小的原子可能是( )
| A. | ns2np3 | B. | ns2np5 | C. | ns2np4 | D. | ns2np6 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,2.24 L苯含有的分子数为0.1NA | |
| B. | 100ml 1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |