题目内容
4. 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.(1)NaH是一种生氢剂,NaH与H2O反应放出H2.NaH含有的化学键为离子键(填“离子键”或“共价键”),NaH与H2O反应的化学方程式为NaH+H2O=NaOH+H2↑.
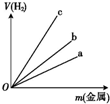
(2)写出实验室用锌与稀硫酸反应制取H2的离子方程式:Zn+2H+=Zn2++H2↑.图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是c(填“a”“b”或“c”).
(3)金属-有机框架物(MOFs)储氢材料是由金属氧化物团簇通过有机高分子链组装形成的晶态材料.MOFs储氢材料比表面积大,空隙率高,储氢容量大,其储氢和放氢的原理可表示为MOFs(s)+nH2(g)$?_{放氢}^{储氢}$(H2)nMOFs(s),△H<0,则储氢时的适宜条件为B(填字母).
A.低温低压 B.低温高压 C.高温低压 D.高温高压
(4)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2.已知:
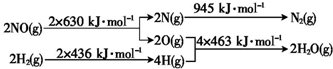
H2还原NO生成氮气和水蒸气的热化学方程式是2NO(g)+2H2(g)=N2(g)+2H2O(g)△H=-665kJ•mol-1.
(5)一定条件下,用H2将二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)?CH4(g)+2H2O(g)
向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min后达到平衡时各物质的浓度分别为:CO2为0.2mol•L-1,H2为0.8mol•L-1,CH4为0.8mol•L-1,H2O为1.6mol•L-1.
①0~10min内v(H2)=0.32mol•L-1•min-1.
②300℃时上述反应的平衡常数K=25,若200℃时该反应的平衡常数K=64.8,则该反应的△H<(填“>”或“<”)0.
分析 (1)NaH是一种生氢剂属于离子化合物,NaH与H2O反应放出H2.是氢元素发生的归中反应;
(2)实验室用锌与稀硫酸反应制取H2,发生置换反应生成硫酸锌和氢气,依据氧化还原反应电子守恒分析,同质量的金属,摩尔电子质量越小,生成氢气越多;
(3)储氢过程是气体体积减小的放热反应,结合化学平衡移动原理分析判断需要合适的条件;
(4)根据能量变化图,则反应断键共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以该反应共放出2797-2132=665kJ的热量,据此书写;
(5)据化学平衡三段式列式计算,
平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
①反应速率V=$\frac{△c}{△t}$计算;
②根据平衡常数为生成物浓度的幂次方之积比上反应物浓度的幂次方之积书写;比较300℃与200℃时的平衡常数K的值判断反应的△H;
解答 解:(1)NaH是一种生氢剂属于离子化合物,NaH含有的化学键为离子键,NaH与H2O反应放出H2发生氧化还原反应反应的化学方程式为:NaH+H2O=NaOH+H2↑;
故答案为:离子键,NaH+H2O=NaOH+H2↑;
(2)实验室用锌与稀硫酸反应制取H2,发生置换反应生成硫酸锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,依据氧化还原反应电子守恒分析,同质量的金属,摩尔电子质量越小,生成氢气越多,锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系可知,同质量的金属生成氢气越多的,其摩尔电子质量越小,摩尔电子质量分别为:Zn为32.5g/mol,Al为9g/mol,Mg为12/mol,所以同质量的金属铝生成氢气最多,图象中c符合;
故答案为:Zn+2H+=Zn2++H2↑,c;
(3)其储氢和放氢的原理可表示为MOFs(s)+nH2(g)$?_{放氢}^{储氢}$(H2)nMOFs(s),△H<0,储氢过程是气体体积减小的放热反应,平衡正向进行,需要的条件为低温高压;
故答案为:B;
(4)根据能量变化图,则反应断键共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以该反应共放出2797-2132=665kJ的热量,热化学方程式为:2NO(g)+2H2(g)=N2(g)+2H2O(g)△H=-665kJ•moL-1;
故答案为:2NO(g)+2H2(g)=N2(g)+2H2O(g)△H=-665kJ•moL-1;
(5)平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
①0~10min内v(H2)=$\frac{3.2mol/L}{10min}$=0.32mol/L•min;
故答案为:0.32mol/L•min;
②反应的平衡常数表达式K=$\frac{c({H}_{2}O){c}^{2}(C{H}_{4})}{c(C{O}_{2}){c}^{4}({H}_{2})}$=$\frac{1.{6}^{2}×0.8}{0.2×0.{8}^{4}}$=25,因为200℃时该反应的平衡常数K=64.8,所以升温K变小,平衡向逆反应方向移动,所以△H<0;
故答案为:25,<.
点评 本题考查了热化学方程式定量计算,化学方程式三段式计算应用,氧化还原反应的理解应用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖)$\stackrel{浓硫酸}{→}$ 6C+6H2O | |
| B. | 向AgNO3溶液中加入过量Na2S溶液后,再加入NaCl溶液,黑色沉淀变成白色:Ag2S+2Cl-=2AgCl↓+S2- | |
| C. | 将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O?NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| D. | 明矾的水溶液pH<7:Al3++3H2O?Al(OH)3(胶体)+3H+ |
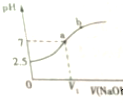 常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )
常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )| A. | NaHSO3溶液呈酸性 | B. | V1<10mL | ||
| C. | 在a点,c(Na+)=c(SO32- )+c(HSO3-) | D. | HSO3-的电离常数Ka=6.25×10-7 |
①2NO+Na2O2=2NaNO2②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+.
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目
 .
.(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO).
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2.
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625.
(结果保留4位有效数字)
| A. | 在标准状况下,2.24 L苯含有的分子数为0.1NA | |
| B. | 100ml 1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |