题目内容
(15分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题: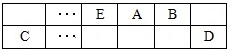
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
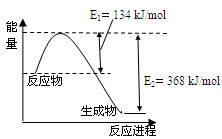
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。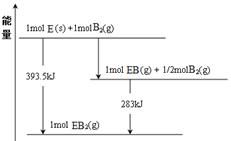

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
(1)NH3·H2O NH4+ + OH- (2)> (3)Al(OH)3(4) ①③
NH4+ + OH- (2)> (3)Al(OH)3(4) ①③
(5)Na3N + 4H2O=3NaOH + NH3·H2O
(6)CO2(g) + C(s) =" 2CO(g)" ;△H=" +172.5kJ/mol"
或1/2CO2(g) + 1/2 C(s) =" CO(g);" △H=" +86.25kJ/mol" (7) Fe3++e-→Fe2+
解析试题分析:根据题意可推知:A是N;B是O;C是Na;D是Cl;E是C;F是Al;G是Fe。(1)NH3的水溶液显碱性,是因为在溶液中存在:NH3+H2O NH3·H2O; NH3·H2O
NH3·H2O; NH3·H2O NH4+ + OH-;(2)NH3+HCl=NH4Cl;若二者等体积混合,则恰好发生反应得到NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,现在所得溶液的pH=7,溶液显中性,所以氨气要过量。因此a>b。(3)Al(OH)3完全沉淀的pH是4.7,Fe(OH)3完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Fe(OH)3先生成沉淀,结构相似的物质,ksp越小的,越易先生成沉淀,这说明kspAl(OH) 3>kspFe(OH) 3,因此ksp较大的是Al(OH)3;(4)A与B可组成质量比为7:16的三原子分子NO2,该分子释放在空气中其化学作用可能引发的后果①酸雨;③光化学烟雾。(5)A和C组成的一种离子化合物Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O.(6)由物质的能量及相互转化关系可得方程式为:CO2(g) + C(s) =" 2CO(g)" ;△H= +172.5kJ/mol。(7)若在Cl与Fe组成的某种化合物FeCl3的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为Fe3++e-→Fe2+。
NH4+ + OH-;(2)NH3+HCl=NH4Cl;若二者等体积混合,则恰好发生反应得到NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,现在所得溶液的pH=7,溶液显中性,所以氨气要过量。因此a>b。(3)Al(OH)3完全沉淀的pH是4.7,Fe(OH)3完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Fe(OH)3先生成沉淀,结构相似的物质,ksp越小的,越易先生成沉淀,这说明kspAl(OH) 3>kspFe(OH) 3,因此ksp较大的是Al(OH)3;(4)A与B可组成质量比为7:16的三原子分子NO2,该分子释放在空气中其化学作用可能引发的后果①酸雨;③光化学烟雾。(5)A和C组成的一种离子化合物Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O.(6)由物质的能量及相互转化关系可得方程式为:CO2(g) + C(s) =" 2CO(g)" ;△H= +172.5kJ/mol。(7)若在Cl与Fe组成的某种化合物FeCl3的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为Fe3++e-→Fe2+。
考点:考查元素的推断、物质的性质、相互转化、影响及化学方程式、热化学方程式的书写、原电池的设计及反应原理的知识。

工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: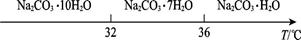
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s)
 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1Na2CO3·10H2O(s)
 Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)  ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1写出Na2CO3·H2O脱水反应的热化学方程式: 。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | N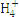 | S | N | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+
 O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①
O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①C(s)+
 O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g)
 2NO(g) ΔH>0
2NO(g) ΔH>0若1 mol空气含0.8 mol N2和0.2 mol O2,1 300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g) 2C(s)+O2(g)
已知该反应的ΔH>0,简述该设想能否实现的依据:
。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
(16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)
 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1 ⅱ 2C(s)+ O2(g)
 2CO(g) △H ="-" 221.0 kJ·mol-1
2CO(g) △H ="-" 221.0 kJ·mol-1ⅲ C(s)+ O2(g)
 CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1温度升高,反应ⅲ化学平衡常数 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
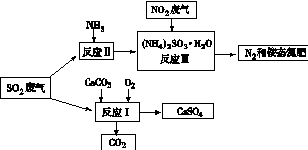
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是 。
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1mol·Lˉ1 双氧水 | 1 mol·L1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2Iˉ= 2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X完全反应时,两者物质的量之比为1∶2。按表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X) ~ t的变化曲线图(进行相应的标注)。

(4)实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)
 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。(6)已知:N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) △H1= -640kJ/mol
H2O(l)=H2O(g) △H2=+44.0kJ/mol
则0.25mol 液态肼与液态双氧水反应生成液态水时放出的热量是 。
 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
 N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。

 CH3OH(g)。
CH3OH(g)。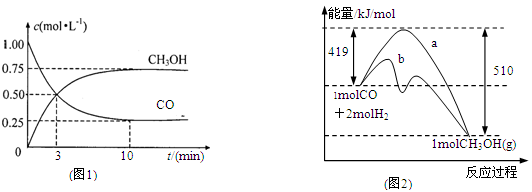
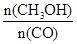 增大的有
增大的有