��Ŀ����
��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO(g)+2H2(g) 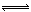 CH3OH(g)��
CH3OH(g)��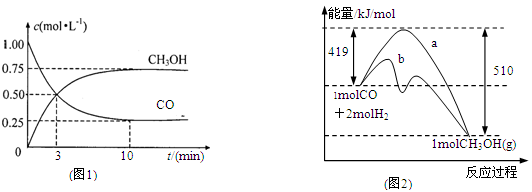
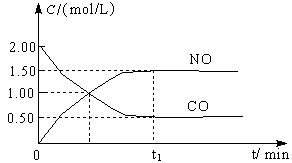
��1��ͼ1�DZ�ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯������ӷ�Ӧ��ʼ��ƽ�⣬��COŨ�ȱ仯��ʾƽ����Ӧ����v(CO)=
��2��ͼ2��ʾ�÷�Ӧ���й����������ı仯������a��ʾ��ʹ�ô���ʱ��Ӧ�������仯������b��ʾʹ�ô�����������仯���÷�Ӧ��_________��ѡ����ȡ����ȡ�����Ӧ��д����Ӧ���Ȼ�ѧ����ʽ ��
��3���÷�Ӧƽ�ⳣ��KΪ______________���¶����ߣ�ƽ�ⳣ��K_________(����������䡱��С��)
��4�����������£����д�ʩ����ʹ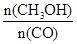 �������
�������
a�������¶� b������He��
c���ٳ���2 molH2 d��ʹ�ô���
��10�֣���1��0.075 mol��L��1��min��1��2�֣�
��2�����ȣ�1�֣��� CO(g)+2H2(g) 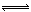 CH3OH(g) ��H ����91 kJ��mol��1��2�֣���
CH3OH(g) ��H ����91 kJ��mol��1��2�֣���
��3��12 mol��2��L2��2�֣�����С��1�֣� ��4��c��2�֣�
���������������1������ͼ1��֪��COŨ�ȱ仯��Ϊ1.00mol/L��0.25mol/L��0.75mol/L����Ӧ���е�10minʱŨ�Ȳ��ٷ����仯��˵����Ӧ�ﵽƽ��״̬������v��CO����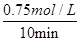 ��0.075mol/��L?min����
��0.075mol/��L?min����
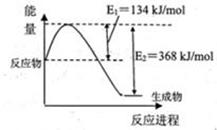
��2������ͼ2��֪����Ӧ�������������������������������Ը÷�Ӧ�Ƿ��ȷ�Ӧ����������1mol��̬�״��ų���������510kJ��419kJ��91kJ����˸÷�Ӧ���Ȼ�ѧ����ʽ��CO(g)+2H2(g)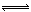 CH3OH(g) ��H ����91 kJ��mol��1��
CH3OH(g) ��H ����91 kJ��mol��1��
��3������ͼ1��֪��ƽ��ʱCO�ͼ״���Ũ�ȷֱ���0.25mol/L��0.75mol/L��������Ũ����4mol��2L��0.75mol/L��2��0.5mol/L�����Ը��ݷ�Ӧ�Ļ�ѧ����ʽCO(g)+2H2(g)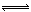 CH3OH(g)��֪�����¶��µ�ƽ�ⳣ��K��
CH3OH(g)��֪�����¶��µ�ƽ�ⳣ��K��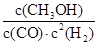 ��
��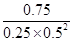 ��12 mol��2��L2��
��12 mol��2��L2��
��4��a�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����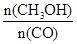 ��С��a����ȷ��b������He���������ݻ����䣬ƽ�ⲻ�ƶ���
��С��a����ȷ��b������He���������ݻ����䣬ƽ�ⲻ�ƶ���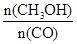 ���䡣���ѹǿ���䣬�������ݻ�����ƽ�����淴Ӧ�����ƶ���
���䡣���ѹǿ���䣬�������ݻ�����ƽ�����淴Ӧ�����ƶ���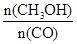 ��С��b����ȷ��c���ٳ���2 molH2��ƽ��������Ӧ�����ƶ�������
��С��b����ȷ��c���ٳ���2 molH2��ƽ��������Ӧ�����ƶ�������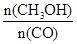 ����c��ȷ��d��ʹ�ô�����ƽ�ⲻ�ƶ���
����c��ȷ��d��ʹ�ô�����ƽ�ⲻ�ƶ���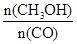 ���䣬d����ȷ����ѡc��
���䣬d����ȷ����ѡc��
���㣺���鷴Ӧ���ʡ�ƽ�ⳣ���ͷ�Ӧ�ȵļ��㡢���������ƽ��״̬��Ӱ���

 �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д� ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�ͼa��1 mol NO2��1 mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��ͼb�Ƿ�Ӧ�е�CO��NO��Ũ����ʱ��仯��ʾ��ͼ������ͼ��ش��������⣺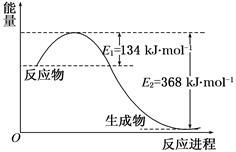
a b
(1)д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
(2)�ӷ�Ӧ��ʼ��ƽ�⣬��NO2Ũ�ȱ仯��ʾƽ����Ӧ����v(NO2)�� ��
(3)���¶��¸÷�Ӧ��ƽ�ⳣ��K= ���¶Ƚ��ͣ�K ����������С�����䡱��
(4)�����¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2��1 mol CO 1 mol NO��1 mol CO2 |
| ƽ��ʱc(NO) /mol��L-1 | 1.5 | 3 | m |
| �����仯 | �ų�a kJ | ����b kJ | �ų�c kJ |
| CO��NO��ת���� | ��1 | ��2 | ��3 |
��1+��2= �� a+b/2= ,m=
�����ߡ�������д���ҹ�������ҵ����ƪ�¡����������Ҫ���ܵ�ȼ�ϣ�ͨ������(N2H4)��Ϊȼ�ϣ�N2O4����������
��1����֪��N2(g) + 2O2(g) =2NO2(g) ��H����67.7 kJ��mol��1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) ��H����534.0 kJ��mol��1
2NO2(g) N2O4(g) ��H����52.7 kJ��mol��1
N2O4(g) ��H����52.7 kJ��mol��1
��д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ�� ��
��2����ҵ�Ͽ��ô�������������İ���Ӧ�Ʊ��£��÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��3��һ�������£���2L�ܱ���������ʼͶ��2 mol NH3��4 mol O2������Ӧ��
4NH3(g)+5O2(g�� 4NO(g)+6H2O(g) ��H<0
4NO(g)+6H2O(g) ��H<0
���ƽ��ʱ�������£�
| ƽ��ʱ���ʵ�����mol�� | n(NO) | n(H2O�� |
| �¶�T1 | 1.6 | 2.4 |
| �¶�T2 | 1.2 | 1.8 |
�����¶�T1�£�������10min��Ӧ�ﵽƽ�⣬��10min�ڷ�Ӧ��ƽ������
v(NH3)�� ��
���¶�T1��T2�Ĵ�С��ϵ��T1 T2���>���� ��<����������
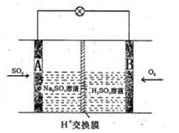
��4�������˺���������̬ϵͳ�У�����Ҫ�����ȥ��CO2����Ҫ���ṩ�����O2��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2CO2=2CO+O2��CO������ȼ�ϡ���֪�÷�Ӧ��������ӦΪ��
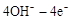 =O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ��
=O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ����5����ͼ��ij�ռ�վ����ת��ϵͳ�ľֲ�ʾ��ͼ������ȼ�ϵ�ز���KOH��ҺΪ���Һ��
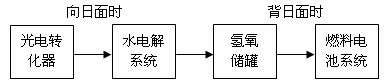
���ij��ʱ�������������й��ռ���33.6L���壨������ɱ�״��������ö�ʱ����ˮ���ϵͳ��ת�Ƶ��ӵ����ʵ���Ϊ mol��
I����ҵ�Ͽ���CO����ȼ�ϼ״���һ�������·�����Ӧ��CO(g)+2H2(g) CH3OH(g)
CH3OH(g)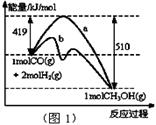
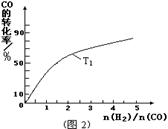
��1����ͼ1����ʾ��Ӧ�������ı仯������ ���a��b������ʾʹ���˴������÷�Ӧ���Ȼ�ѧ����ʽΪ ��
��2���������ݻ����䣬���д�ʩ������COƽ��ת���ʵ���_____��
| A�������¶� |
| B����CH3OH(g)����ϵ�з��� |
| C������He��ʹ��ϵ��ѹǿ���� |
| D���ٳ���1 mol CO��2 mol H2 |
II����BaSO4�����м��뱥��̼������Һ����ֽ��裬��ȥ�ϲ���Һ����˴�����Σ���ʹBaSO4ȫ��ת��ΪBaCO3�������ķ�Ӧ�ɱ�ʾΪ��BaSO4(s)+CO32��(aq)
 BaCO3(s)+SO42��(aq)��
BaCO3(s)+SO42��(aq)����4������0.20 mol BaSO4������1.0L 2.0mol/L�ı���Na2CO3��Һ������������ʼ��c(SO42��)��0��ƽ��ʱ��K=4.0��10��2����ﵽƽ��ʱ����ת����BaSO4�����ʵ�������д��������̣�����������2λ��Ч���֣�
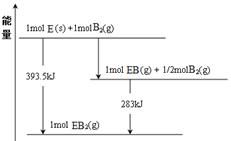

 N2(g)��2CO2(g)�ġ�H�� ��
N2(g)��2CO2(g)�ġ�H�� ��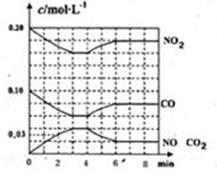
 Fe3O4(s)+4H2(g) ��H=akJ/mol ��I��
Fe3O4(s)+4H2(g) ��H=akJ/mol ��I��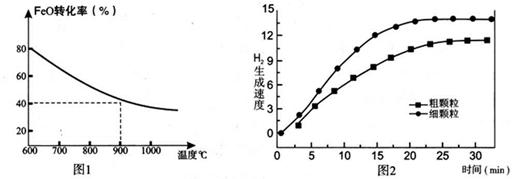
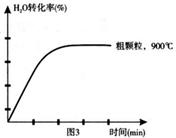
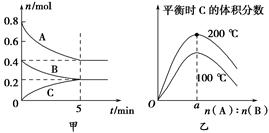
 zC(g)��ͼ�ױ�ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ�ұ�ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���ǣ� ����
zC(g)��ͼ�ױ�ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ�ұ�ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���ǣ� ����