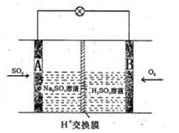
��Ŀ����
��֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ������
�������еμ�˫��ˮ��������Ӧ��H2O2+2H++2I��=2H2O+I2��
�����ɵ�I2�������Լ�X��Ӧ�����Լ�X����������ɵ� I2�Ż������۱�����ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㣺H2O2+2H++2I��= 2H2O+I2�ķ�Ӧ���ʡ�
�±�Ϊijͬѧ��������ԭ����Ƶ�ʵ�鼰ʵ���¼����ʵ��������������½��У���
| ��� | ���ձ��м�����Լ�����������mL�� | ���� | ��ʼ����ʱ�䣨min�� | ||||
| 0��1 mol��L��1 KI��Һ | H2O | 0��01 mol��L��1 X��Һ | 0��1mol��L��1 ˫��ˮ | 1 mol��L1 ϡ���� | |||
| 1 | 20��0 | 10��0 | 10��0 | 20��0 | 20��0 | �� | 1��4 |
| 2 | 20��0 | m | 10��0 | 10��0 | n | �� | 2��8 |
| 3 | 10��0 | 20��0 | 10��0 | 20��0 | 20��0 | �� | 2��8 |
| 4 | 20��0 | 10��0 | 10��0 | 20��0 | 20��0 | 5��Fe2(SO4)3 | 0��6 |
��1����֪��ʵ��1��2��Ŀ����̽��H2O2Ũ�ȶ�H2O2+2H++2I��= 2H2O+I2��Ӧ���ʵ�Ӱ�졣ʵ��2��m= ��n= ��
��2����֪��I2��X��ȫ��Ӧʱ���������ʵ���֮��Ϊ1��2���������е�X��KI�ļ�����������V��H2O2��>________����ȷ��������ɫ��
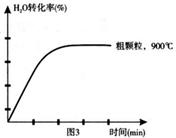
��3��ʵ��1��Ũ��c(X)�� t�ı仯������ͼ�������������������䣬���ڴ������ͼ�У��ֱ�ʵ��3��ʵ��4��c(X) �� t�ı仯����ͼ��������Ӧ�ı�ע����

��4��ʵ��4����������������߷�Ӧ���ʡ������ܼӿ췴Ӧ��������Ϊ���� (���ߡ����͡�)�˷�Ӧ��ܡ�
��5�������Ѻ����������������Ƴɹ�����֪����ܷ�ӦΪ��2Al(s)+3I2(s)
 2AlI3(s)����I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��________________________�����ʱAl���ӵ�Դ��___________����
2AlI3(s)����I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��________________________�����ʱAl���ӵ�Դ��___________������6����֪��N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) ��H1= ��640kJ/mol
H2O��l��=H2O��g�� ��H2��+44.0kJ/mol
��0.25mol Һ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų��������� ��
��17�֣�
��1��20��0��2�֣� 20��0 ��2�֣�
��2��0��5mL ��2�֣�
��3����ͼ3�֣���ע1�֣� 
��4�����ͣ�2�֣�
��5��Al��3e��+3I��= AlI3 ��2�֣� ������2�֣�
��6��204 kJ ��2�֣�
���������������1��ʵ��1��2��Ŀ����̽����������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬��KI��Һ��Ũ�Ⱥ������X��Ũ�Ⱥ������ϡ�����Ũ�Ⱥ����������ͬ������n=20.0��������Һ���������ȣ���m=20.0��ʹʵ��1��˫��ˮ��Ũ�ȴ���ʵ��2�����Ͽ��Ʊ������ʵ�鷽����Ҫ��2������n=c?V�����ݱ������ݿ�����X�����ʵ���Ϊ 0.0001mol������I2��X��ȫ��Ӧʱ���������ʵ���֮��Ϊ1��2��������I2�����ʵ���Ϊ0.00005mol������H2O2+2H++2I��= 2H2O+I2�й���������ⵥ�ʵ�ϵ��֮�ȵ������ʵ���֮�ȣ�����Ҫ������������ʵ���Ϊ0.00005mol��ֻ�й�����������ʵ�������0.00005molʱ���ⵥ�ʲŻ����������ȷ����ɫ������V=n/c����V��H2O2��>0.00005mol��0��1mol��L��1=0.0005L="0." 5mL����3��ʵ��1��3�����Ǽ�СKI��ҺŨ�ȣ���С��Ӧ��Ũ�ȣ���Ӧ���ʼ�С���÷�Ӧ�ܽ��е��ף���X��ҺŨ�ȼ�С��0��ʱ���ʵ��1��һЩ��ʵ��1��4������ʹ����5���������������������ܼӿ췴Ӧ���ʣ��÷�Ӧ�ܽ��е��ף���X��ҺŨ�ȼ�С��0��ʱ�����Ա�ʵ��1��һЩ����4�������ܼӿ췴Ӧ���ʣ���Ҫԭ���Ǵ����ܽ��ͷ�Ӧ�Ļ�ܣ���5����������������Ӧ������Ԫ�ػ��ϼ����ߣ���Ӧ��ʧȥ���ӣ����ݵ��ӡ���ɡ�ԭ���غ�ԭ���ɵã�Al��3e��+3I��= AlI3�����ʱ�ܷ�ӦΪ2AlI3(s) 2Al(s)+3I2(s)����Ԫ�صĻ��ϼ���+3�۽�Ϊ0�ۣ�������ԭ��Ӧ�����ڵ���������������ԭ��Ӧ��������ֱ����Դ�ĸ�����������Al���ӵ�Դ�ĸ�������6���Ƚ���֪�Ȼ�ѧ����ʽ���Ϊ�٢ڣ����ݸ�˹���ɺ����⣬�ɢ١��ڡ�4�ɵã�N2H4(l) +2H2O2(l)= N2(g)+4H2O(l) ��H= ��816kJ/mol����1molҺ̬��Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų�772kJ���������0.25molҺ̬��Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų�������Ϊ0.25��816kJ=204kJ��
2Al(s)+3I2(s)����Ԫ�صĻ��ϼ���+3�۽�Ϊ0�ۣ�������ԭ��Ӧ�����ڵ���������������ԭ��Ӧ��������ֱ����Դ�ĸ�����������Al���ӵ�Դ�ĸ�������6���Ƚ���֪�Ȼ�ѧ����ʽ���Ϊ�٢ڣ����ݸ�˹���ɺ����⣬�ɢ١��ڡ�4�ɵã�N2H4(l) +2H2O2(l)= N2(g)+4H2O(l) ��H= ��816kJ/mol����1molҺ̬��Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų�772kJ���������0.25molҺ̬��Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų�������Ϊ0.25��816kJ=204kJ��
���㣺���黯ѧ��Ӧԭ�����漰���ʵ�鷽��̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졢���ʵ����ڻ�ѧ����ʽ�����ӷ���ʽ�е�Ӧ�á����ʵ���Ũ�ȡ���Һ����������ʵ�����Ũ�Ⱥʹ���Ӱ�췴Ӧ���ʵ�ͼ����Ӱ�췴Ӧ���ʵ�ԭ�����ͳ���ء�������Ӧʽ�����ԭ������˹���ɡ���Ӧ�ȵ��йؼ���ȡ�

 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д���¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ��H =" a" kJ mol��1
2Fe(s)+3CO2(g) ��H =" a" kJ mol��1
��1����֪��
��Fe2O3(s)+3C(ʯī) = 2Fe(s)+3CO(g) ��H1 =" +" 489.0 kJ mol��1
��C(ʯī)+CO2(g) = 2CO(g) ��H2 =" +" 172.5 kJ mol��1
��a = kJ mol��1��
��2��ұ������Ӧ��ƽ�ⳣ������ʽK = ���¶����ߺ�Kֵ ������������䡱��С������
��3����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=64����2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
| | Fe2O3 | CO | Fe | CO2 |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
�� ��������CO��ƽ��ת����Ϊ ��
�� ����˵����ȷ���� ������ĸ����
a���������������ܶȺ㶨ʱ����־��Ӧ�ﵽƽ��״̬
b����������CO��ƽ��ת���ʴ����ҵ�
c���ס��������У�CO��ƽ��Ũ��֮��Ϊ2��3
d������Fe2O3�������CO��ת����
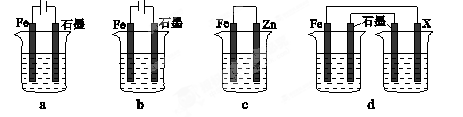
��4����ȡһ����ʩ�ɷ�ֹ������ʴ������װ���е��ձ����ʢ�е�Ũ�ȡ��������NaCl��Һ��
����a��cװ���У��ܱ��������� ������ĸ����
������dװ�ñ�������X���ĵ缫����Ӧ�� �������ƣ���
��һ�������£������ܱ������н��еĿ��淴ӦA��g����3B��g��
|
C����λʱ������ n mol A��ͬʱ���� 3nmol B D�� A��B��C�ķ�����֮��Ϊ 1��3��2
��Ʒ�Һ��Cr2O72����ͨ�����з�Ӧת���ɸ��ƣ�PbCrO4����
Cr2O72����aq��+ 2Pb2+��aq��+ H2O��l�� 2PbCrO4��s��+ 2H+��aq����H��0
2PbCrO4��s��+ 2H+��aq����H��0
�÷�Ӧ��ƽ��ı�����������˵����ȷ����
| A�����߲���PbCrO4���壬Cr2O72��ת�������� |
| B�������¶ȣ��÷�Ӧ��ƽ�ⳣ����K������ |
| C����������NaOH���壬��Ȼ��������Һ��ɫ��dz |
| D����������K2Cr2O7�������Һ��c(H+)���� |
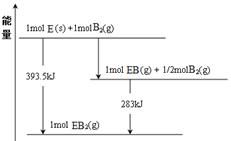

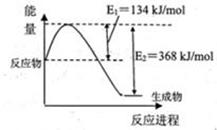
 N2(g)��2CO2(g)�ġ�H�� ��
N2(g)��2CO2(g)�ġ�H�� ��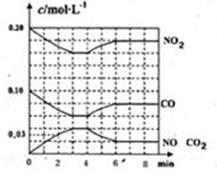
 Fe3O4(s)+4H2(g) ��H=akJ/mol ��I��
Fe3O4(s)+4H2(g) ��H=akJ/mol ��I��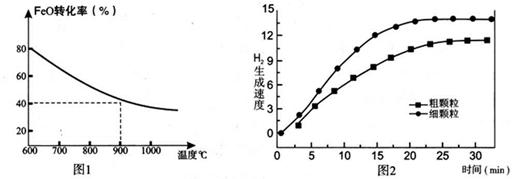
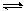
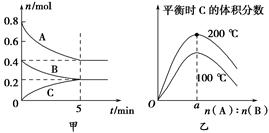
 zC(g)��ͼ�ױ�ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ�ұ�ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���ǣ� ����
zC(g)��ͼ�ױ�ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ�ұ�ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���ǣ� ����